Scientific Kalender Juni 2020
Hypertensive Nephropathie
Warum ist der Sysmex Meditape 11A auf dem UC-3500 ein ideales Werkzeug zum Screening auf Albuminurie?
Weil seine Nachweisgrenze 5,5 mg/l beträgt.
Weil es auch die glomeruläre Filtrationsrate misst.
Weil es eine korrekte Beurteilung ermöglicht, wenn es ins Verhältnis zum Kreatinin gesetzt wird.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Wissenschaftliche Hintergrundinformationen
Die chronische Niereninsuffizienz (CKD) ist definiert als strukturelle oder funktionelle Veränderungen der Niere, die seit mehr als drei Monaten bestehen. Die Einteilung der CKD beruht auf der geschätzten glomerulären Filtrationsrate (eGFR) und der Albuminurie [KDIGO]. Die CKD gehört zu einem Krankheitsspektrum, bei dem verschiedene Faktoren die Progression vom akuten Nierenversagen (ANV) über die chronische Niereninsuffizienz bis zur terminalen Niereninsuffizienz (TNI) begünstigen.
Neben verschiedenen Erkrankungen wie persistierenden Harnwegsobstruktionen, chronischen Infektionen der unteren Harnwege, interstitieller Nephritis und Zystenniere ist Hypertonie nach Diabetes mellitus die zweithäufigste Ursache der terminalen Niereninsuffizienz.
Hypertonie kann sowohl Ursache als auch Folge einer chronischen Niereninsuffizienz sein und trägt zu deren Progression bei, da sie sich negativ auf alle Kompartimente der Niere auswirkt: Blutgefäße, Glomeruli und den tubulär-interstitiellen Raum.
Eine chronische Hypertonie führt zu einer hypertensiven Nephropathie, die sich als hypertensive Nephrosklerose äußert, welche durch die Ablagerung von Hyalin (Hyalinose) in den afferenten Arteriolen verursacht wird und zu kleinsten Veränderungen der intraglomerulären Hämodynamik führt. Eine fortbestehende Hyalinose führt jedoch zur Verengung und zu strukturellen Veränderungen der Aorta und Arterien, die an Elastizität und Hämodynamik verlieren. Diese strukturellen Veränderungen und die damit einhergehenden mechanischen Belastungen münden in eine glomeruläre Schädigung (hypertensive Glomerulopathie), beispielsweise durch eine partielle Ischämie, wodurch sich die Glomeruli verengen und die glomeruläre Filtrationsrate sinkt. Innerhalb der Glomeruli bilden Podozyten eine größenselektive Filtrationsbarriere, die essenziell für die glomeruläre Filtration und die Harnproduktion ist. Durch eine Hypertonie werden die Podozyten geschädigt und es kommt zu deren irreversibler Ablösung von der glomerulären Basalmembran, zum Zusammenbruch der Barriere und in der Folge zu einer Proteinurie. Die Hypertonie versursacht zudem vielfältige Läsionen in den renalen tubulären Epithelzellen (Renal Tubular Epithelial Cells – RTEC), wodurch es schließlich zum Untergang von Zellen und zur Freisetzung von entzündungsfördernden Substanzen kommt. Angiotensin II, ein Vasokonstriktor des den Blutdruck regulierenden Renin-Angiotensin-Systems, begünstigt bekanntermaßen Entzündungen und oxidativen Stress, da es Zytokine und Chemokine induziert. Diese Wechselwirkung induziert den Übergang von Epithelzellen zu mesenchymalen Zellen mittels eines Verlusts der Zellpolarität und einer Veränderung der Zelladhäsion und führt zu einer tubulär-interstitiellen Fibrose sowie zur Progression der chronischen Niereninsuffizienz [SECCIA].
Laborergebnisse
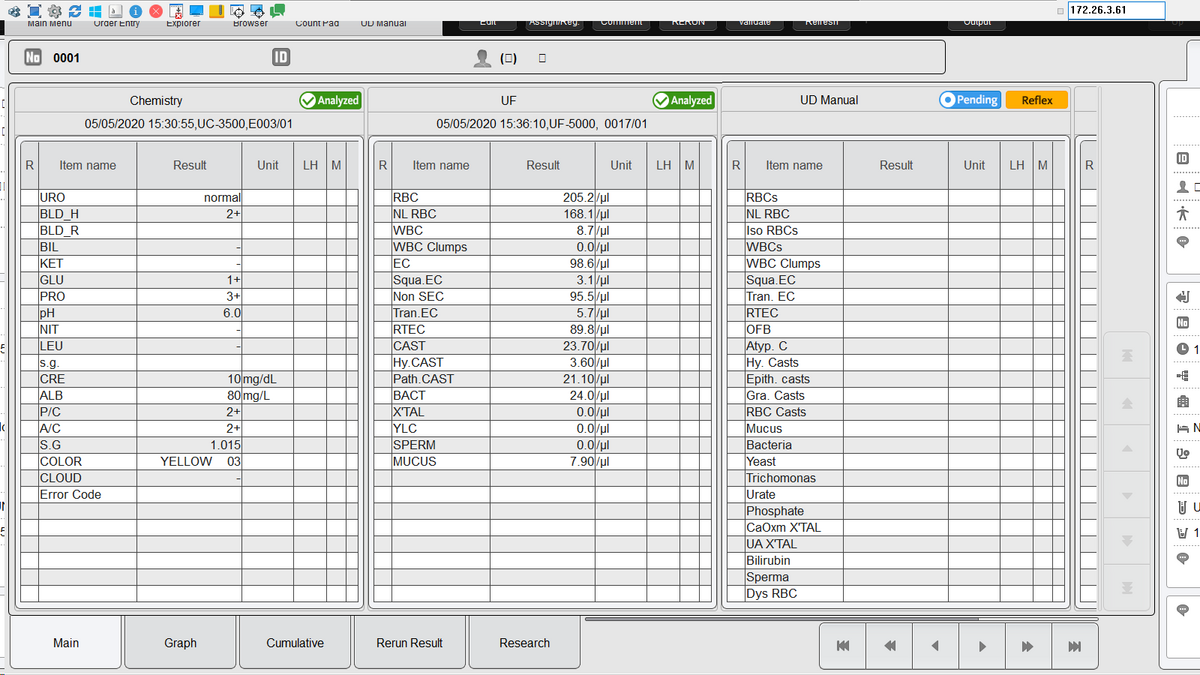
1. Anzeige eines Urinanalyse-Ergebnisses auf dem U-WAMStreifentest auf dem UC-3500
2. Streifentest auf dem UC-3500
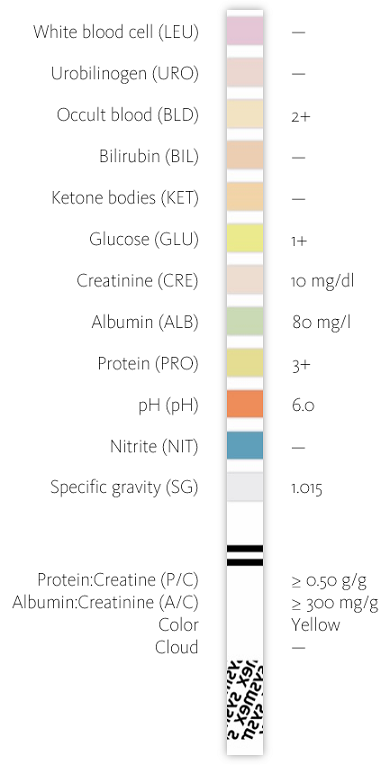
Der Streifentest zeigte eine starke Proteinurie und eine mäßig erhöhte Albuminurie (früher auch als „Mikroalbuminurie“ bezeichnet). Da die Protein- und Albuminkonzentration im Urin durch starkes Schwitzen oder Flüssigkeitszufuhr beeinflusst werden kann, wird sie üblicherweise ins Verhältnis zum Kreatinin gesetzt, um korrekte diagnostische Informationen zu erhalten. Hier wird die stark erhöhte Albuminurie und Proteinurie sowohl durch das Protein-Kreatinin-Verhältnis als auch durch das Albumin-Kreatinin-Verhältnis bestätigt.
Der Einsatz von Meditape 11A Teststreifen auf dem UC-3500 und dessen CMOS-Sensortechnologie belegen das Potenzial einer hochsensitiven Erkennung und quantitativen Bestimmung der Albuminurie mit einem auf Farbstoffbindung basierenden Albumin-Testfeld. Die Albuminkonzentration lässt sich nicht nur in groben Stufen abschätzen, sondern mit einer Nachweisgrenze von 5,5 mg/l quantitativ bestimmen. Die Bestimmung der Albuminurie ist somit nicht nur bei mäßig erhöhten, sondern auch bei physiologischen Konzentrationen möglich, vergleichbar mit der immunonephelometrischen Analyse [DELANGHE].
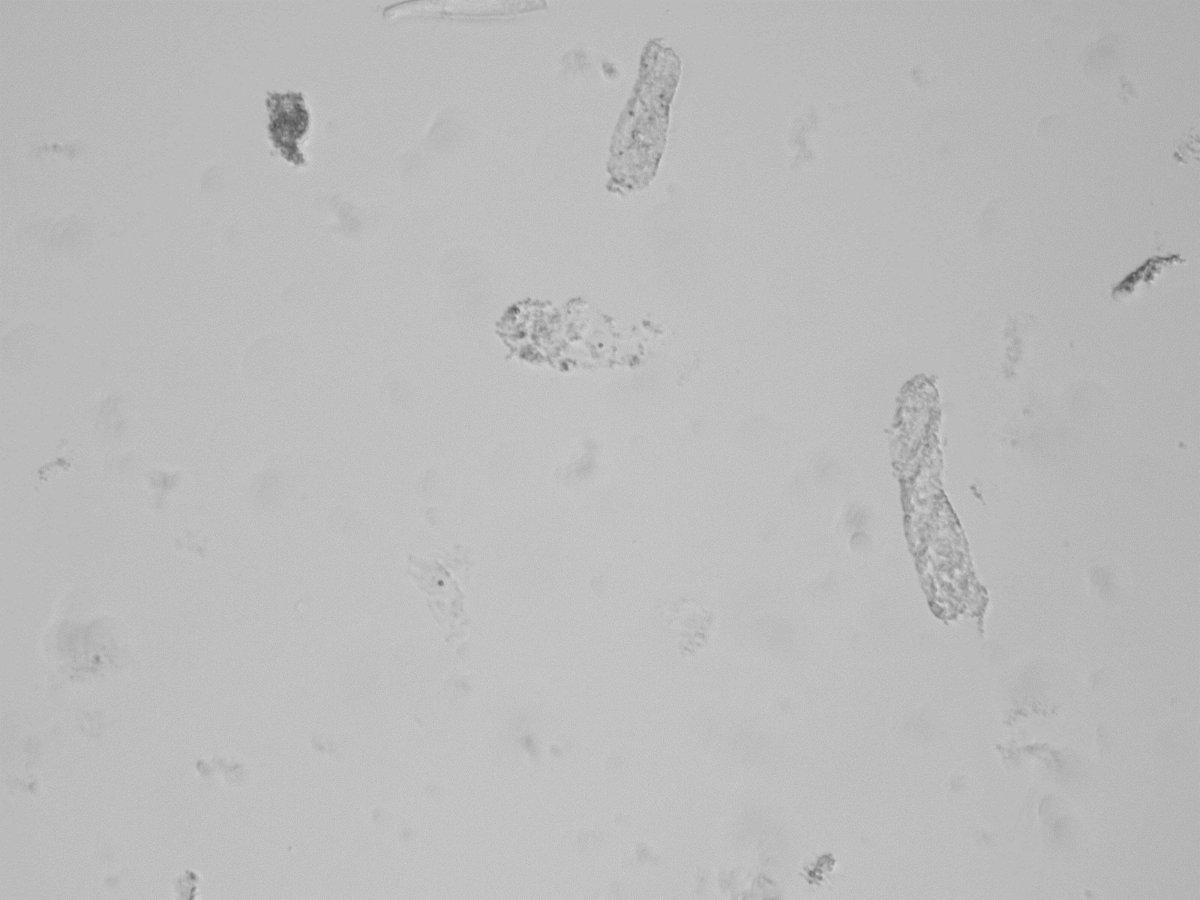
3. Renale tubuläre Epithelzellen auf dem UF-5000
Das UF-5000 hat renale tubuläre Epithelzellen detektiert. Die RTEC bedecken die Nierentubuli vom Tubulus proximalis über die Henle-Schleife bis zum Tubulus distalis und spielen eine zentrale Rolle in der renalen Regeneration, setzen jedoch auch proinflammatorische Moleküle frei, welche die Progression der chronischen Niereninsuffizienz fördern. Aufgrund der normalen Exfoliation können zwar auch im Urin Gesunder einige RTEC vorhanden sein, doch das Vorliegen von ≥ 15 RTEC (pro zehn HPF) weist auf eine aktive Nierenerkrankung oder tubuläre Schädigung hin.
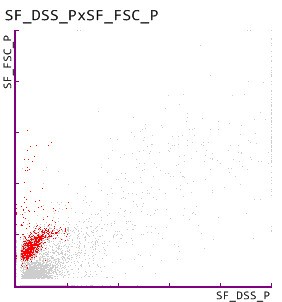
4. Dysmorphe RBC auf dem UF-5000
Mit der Detektion von dysmorphen RBC, die als Indikatoren für eine glomeruläre Schädigung bekannt sind [Fairly and Birch], bestätigte das UF-5000 die vom UC-3500 angezeigt Hämaturie.
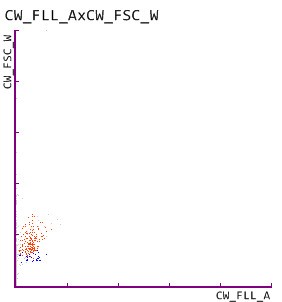
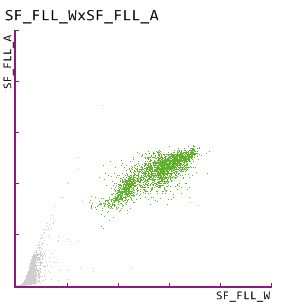
5. Harnzylinder auf dem UF-5000 und dem UD-10
Das Glycoprotein Uromodulin, auch als Tamm-Horsfall-Protein bezeichnet, wird ausschließlich von renalen Tubulizellen in der distalen Henle-Schleife gebildet [BACHMANN]. Die Ausfällung und Aggregation von Uromodulin in den Nierentubuli führt zur Bildung von Harnzylindern. Hyalinzylinder werden auch bei Gesunden häufig beobachtet, doch ihre Zahl nimmt bei einer bestehenden Nierenerkrankung zu. Pathologische Zylinder, wie sie vom obigen Scattergramm angezeigt werden, weisen auf eine Nierenerkrankung hin, und ihr Vorliegen wurde durch den Nachweis von pathologischen Zylindern auf dem UD-10 bestätigt.
Literatur
Bachmann S, Koeppen-Hagemann I, Kriz W (1985): Ultrastructural localization of Tamm-Horsefall glycoprotein (THP) in rat kidney as revealed by protein A-gold immunocytochemistry. Histochemistry 83(6):531–538.
Cassia MA, Pozzi FE, Bascapè S, Saggiante L, Daminelli G, Cirelli C, Damavandi PT, Elli M, Gallieni M (2016): Proteinuria and albuminuria at point of care. Point of Care 2(1):e8–e16.
Delanghe JR, Himpe J, De Cock N, Delanghe S, De Herde K, Stove V, Speeckaert MM (2017): Sensitive albuminuria analysis using dye-binding based test strip. Clin Chim Acta 471:107–112.
Enko D, Stelzer I, Boeckl M, Derler B, Schnedl WJ, Anderssohn P, Meinitzer A and Herrmann M (2020): Comparison of the diagnostic performance of two automated urine sediment analysers with manual phase-contrast microscopy. Clin Chem Lab Med 58(2):268–273.
Fairley JK, Owen JE, Birch DF (1983): Protein composition of urinary casts from healthy subjects and patients with glomerulonephritis. Br Med J 287(6408):1838–1840.
KDIGO (2012): Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter., Suppl. 2013; 3:1–150.
Oyaert M, Delanghe JR (2019): Semiquantitative, Fully Automated Urine Test Strip Analysis. J Clin Lab Anal 33(5):e22870.
Pugh D, Gallacher PJ, Dhaun N (2019): Management of Hypertension in Chronic Kidney Disease. Drugs 79:365–379.
Seccia TM, Caroccia B, Calo LA (2017): Hypertensive nephropathy. Moving from classic to emerging pathogenetic mechanisms. Journal of Hypertension 35:205–212.