Scientific Kalender September 2020
Thrombotisch-thrombozytopenische Purpura (TTP)
Welche Laborbefunde sind für Patienten mit thrombotisch-thrombozytopenischer Purpura (TTP) typisch?
Thrombozytenzahl > 30 x 109/l; LDH erhöht; Hämoglobin und Haptoglobin verringert; Schistozyten im Ausstrich von peripherem Blut; ADAMTS13-Konzentration 20–40 % des Normwerts; und vWF stellt sich normal dar
Thrombozytenzahl > 30 x 109/l; LDH, Hämoglobin und Haptoglobin verringert; Ausstrich von peripherem Blut ohne offenkundige Befunde; ADAMTS13-Konzentration < 10 % des Normwerts; und ungewöhnlich große vWF-Multimere
Thrombozytenzahl < 30 x 109/l; LDH erhöht; Hämoglobin und Haptoglobin verringert; Schistozyten im Ausstrich von peripherem Blut; ADAMTS13-Konzentration < 10 % des Normwerts; und ungewöhnlich große vWF-Multimere
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Wissenschaftliche Hintergrundinformationen
Die thrombotisch-thrombozytopenische Purpura (TTP) ist eine Bluterkrankung und durch das Vorliegen von Folgendem charakterisiert: mikroangiopathische hämolytische Anämie (MAHA) und mittelschwere bis schwere Thrombozytopenie; Purpura oder Blutungen in Verbindung mit einer Thrombozytopenie; Fieber; neurologische Beeinträchtigungen; sowie eine Nierenerkrankung in Verbindung mit Hämaturie und/oder Proteinurie oder erhöhtem Blut-Harnstoff-Stickstoff-Wert.
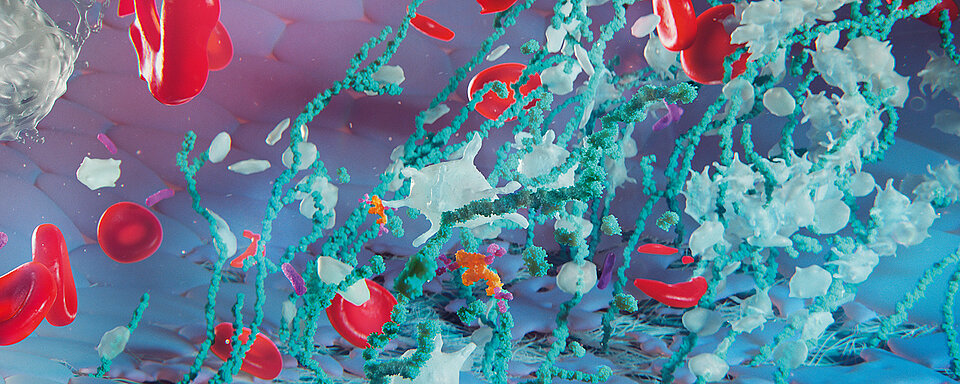
Laboruntersuchungen ergeben für gewöhnlich eine Thrombozytenzahl unterhalb von 30 x 109/l, erhöhte Laktatdehydrogenase-Spiegel, verringerte Hämoglobin- und Haptoglobinspiegel, Vorliegen von Schistozyten im Ausstrich von peripherem Blut, ungewöhnlich große (unusually large, UL) Multimere des von-Willebrand-Faktors (vWF), und einen „A Disintegrin And Metalloproteinase with a ThromboSpondin type 1 motif, member 13“(ADAMTS-13)-Spiegel unterhalb von 10 % des Normwerts. Alle diese Befunde sind bei Vorliegen klinischer Merkmale für TTP hochspezifisch [1, 2].
Die für die Spaltung des von-Willebrand-Faktors (vWF) spezifische Protease ADAMTS-13 reguliert das Vorliegen von vWF-Multimeren nach deren Sezernierung aus Endothelzellen. Die Protease spaltet die Bindung zwischen 1605Tyr und 1606Met in der A2-Domäne. Unter hohen Scherkräften bleiben die von den Endothelzellen sezernierten vWF-Multimere am Endothelium unter Erhalt der für die Spaltung erforderlichen fibrillären Struktur gebunden. Somit sind die Spaltstellen in den A2-Domänen für die frei zirkulierende ADAMTS-13 zugänglich; es kommt zur Spaltung der vWF-Multimere. Unter normalen, nicht-thrombotischen Bedingungen ist der verbleibende vWF nicht reaktiv. Aufgrund seiner Eigenschaften als ein Akute-Phase-Protein können Infektionen oder inflammatorische Prozesse zu einer erhöhten Freisetzung von vWF führen. In Menschen mit einem erworbenen oder erblichen ADAMTS-13-Mangel kann dies zur Bildung von Mikrothrombi und der Entwicklung von klinischen Anzeichen einer TTP führen [3, 4].
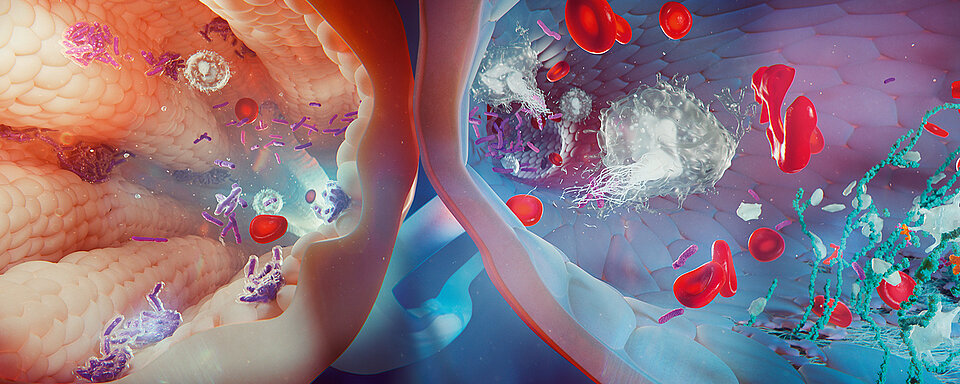
Es ist wichtig, TTP von anderen thrombotischen Mikroangiopathien (TMAs) zu unterscheiden. Bei Patienten mit einer infektionsassoziierten TMA können sich infolge von systemischen bakteriellen, viralen oder mykotischen Infektionen eine MAHA und Thrombozytopenie entwickeln. Daher sollte bei der Beurteilung solcher Patienten auch immer an eine mit einer Infektion einhergehenden TMA gedacht werden; dies gilt insbesondere für ältere Patienten mit Fieber oder Schüttelfrost in Verbindung mit Merkmalen einer TTP. Eine Infektion kann auch eine akute TTP-Episode auslösen. Möglicherweise ist es schwierig zu unterscheiden, ob die Infektion die Ursache oder der Auslöser ist [5]. Die ADAMTS-13-Aktivität bei Patienten mit einer infektionsassoziierten TMA ist für gewöhnlich eigenständig auf 20 % des Normwerts oder mehr verringert. Allerdings gibt es hier einige Ausnahmen bei Patienten mit z. B schwerer Sepsis, die bei Fehlen eines Inhibitors einen schweren ADAMTS-13-Mangel verursacht [6, 8]. Eine infektionsassoziierte TMA wird durch eine infektionsbedingte Schädigung des Endotheliums ausgelöst, was wiederum zu einer erhöhten Freisetzung von vWF und einen gesteigerten ADAMTS-13-Umsatz führt. Bakterielle Enzyme und Zytokine führen zur Proteolyse und Inhibition von ADAMTS-13 [6]. Darüber hinaus können primär aus Chromatinfasern neutrophiler Granulozyten bestehende Netzwerke (sogenannte Neutrophil Extracellular Traps, NETs), die während einer Infektion von Neutrophilen freigesetzt werden, aufgrund ihrer Fähigkeit zur Thrombozytenaktivierung zu einer Thrombose führen. Bei Patienten, die positiv für das humane Immundefizienzvirus (HIV) sind, können die Merkmale einer TMA auf verschiedene Ursachen einschließlich einer koexistierenden TTP zurückzuführen sein. Hierzu gehört auch eine fortgeschrittene Erkrankung mit opportunistischen Infektionen, Malignomen in Verbindung mit dem Erhalt von Antiviralia. Des Weiteren kann die Einleitung einer hochaktiven antiretroviralen Therapie (HAART) die Aktivität von ADAMTS-13 verringern und zu Merkmalen einer TMA führen [9, 10].
Literatur
[1] Zheng XL, Kaufman RM, Goodnough LT, Sadler JE (2004): Effect of plasma exchange on plasma ADAMTS13 metalloprotease activity, inhibitor level, and clinical outcome in patients with idiopathic and non-idiopathic thrombotic thrombocytopenic purpura. Blood; 103: 4043–9.
[2] Rock GA, Shumak KH, Buskard NA, Blanchette VS, Kelton JG, Nair RC, Spasoff RA (1991): Comparison of plasma exchange with plasma infusion in the treatment of thrombotic thrombocytopenic purpura. Canadian Apheresis Study Group. N Engl J Med; 325: 393–7.
[3] Kalagara T, Moutsis T, Yang Y, et al. (2018): The endothelial glycocalyx anchors von Willebrand factor fibers to the vascular endothelium. Blood Adv.; 2(18):2347–57. doi:10.1182/bloodadvances.2017013995
[4] Nazy I, Elliott TD and Arnold DM (2020): Platelet factor 4 inhibits ADAMTS13 activity and regulates the multimeric distribution of von Willebrand factor. Br J Haematol. doi:10.1111/bjh.16553
[5] Saha M, McDaniel JK, Zheng XL (2017): Thrombotic thrombocytopenic purpura: pathogenesis, diagnosis and potential novel therapeutics. J Thromb Haemost; 15: 1889–900.
[6] Schwameis M, Schorgenhofer C, Assinger A, Steiner MM, Jilma B (2015): VWF excess and ADAMTS13 deficiency: a unifying pathomechanism linking inflammation to thrombosis in DIC, malaria, and TTP. Thromb Haemost; 113: 708–18.
[7] Ono T, Mimuro J, Madoiwa S, Soejima K, Kashiwakura Y, Ishiwata A, Takano K, Ohmori T, Sakata Y (2006): Severe secondary deficiency of von Willebrand factor-cleaving protease (ADAMTS13) in patients with sepsis-induced disseminated intravascular coagulation: its correlation with development of renal failure. Blood; 107: 528–34.
[8] Sorvillo et al. (2019): Plasma Peptidylarginine Deiminase IV Promotes VWF-Platelet String Formation and Accelerates Thrombosis After Vessel Injury. Circulation Research; 125(5): 507–19. https://doi.org/10.1161/CIRCRESAHA.118.314571
[9] George JN, Terrell DR, Vesely SK, Kremer Hovinga JA, Lammle B (2012): Thrombotic microangiopathic syndromes associated with drugs, HIV infection, hematopoietic stem cell transplantation and cancer. Presse Med; 41: e177–88.
[10] Malak S, Wolf M, Millot GA, Mariotte E, Veyradier A, Meynard JL, Korach JM, Malot S, Bussel A, Azoulay E, Boulanger E, Galicier L, Devaux E, Eschwege V, Gallien S, Adrie C, Schlemmer B, Rondeau E, Coppo P; Réseau d’Etude des Microangiopathies Thrombotiques (2008): Human immunodeficiency virus-associated thrombotic microangiopathies: clinical characteristics and outcome according to ADAMTS13 activity. Scand J Immunol; 68: 337–44.