Scientific Kalender Dezember 2022
Welche Laboruntersuchungen müssen für die Diagnose eines Leukozyten-Adhäsionsdefekts vom Typ III (LAD-III) durchgeführt werden?
Beurteilung der Anamnese des Patienten, großes Blutbild, Thrombozytenaggregationstests mittels Lichttransmissions-Aggregometrie (LTA), Beurteilung der Glykoproteine von Thrombozyten mittels Durchflusszytometrie sowie genetische Untersuchungen
Thrombozytenaggregationstests mittels Lichttransmissions-Aggregometrie (LTA), Beurteilung der Glykoproteine von Thrombozyten mittels Durchflusszytometrie sowie genetische Untersuchungen
Großes Blutbild, Thrombozytenaggregationstests mittels Lichttransmissions-Aggregometrie (LTA) und Beurteilung der Glykoproteine von Thrombozyten mittels Durchflusszytometrie
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Leukozyten-Adhäsionsdefekt (LAD)
Die LAD-Syndrome sind eine Gruppe seltener primärer Immundefekte, die in drei Subtypen unterteilt sind: LAD-I, LAD-II und LAD-III. Alle drei Subtypen sind durch eine ausgeprägte Leukozytose, eine beeinträchtigte Leukozytenadhäsion und wiederkehrende Infektionen gekennzeichnet. [1, 2, 3, 4]
LAD wird durch einen Gendefekt verursacht, der autosomal-rezessiv vererbt wird. LAD-I wird durch Mutationen im ITGB2-Gen (21q22.3), das für das β2-Integrin CD18 kodiert, verursacht. [2, 5] LAD-II wird durch eine Mutation im SLC35C1-Gen (11p11.2), das für den Guanosin-5'-diphosphat(GDP)-Fucose-Transporter codiert, verursacht und LAD-III beruht auf einer Mutation im FERMT3-Gen (11q13.1), das für die Isoform Kindlin-3, die sich nur in hämatopoetischen Zellen findet, codiert. [5, 6, 7, 8, 9] Diese Mutationen führen zu einer beeinträchtigten Zelladhäsion, was wiederum unter anderem die Migration von Zellen aus den Gefäßen hin zum Infektionsort einschränkt. [6, 7, 8, 9]
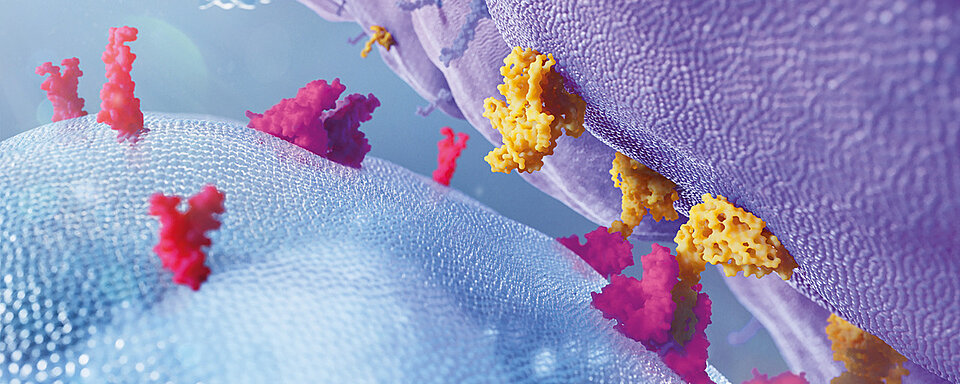
Die Kaskade der Leukozytenadhäsion
Unter physiologischen Bedingungen wird die Kaskade der Leukozytenadhäsion durch das Trapping der Leukozyten und deren Rollen auf dem Endothel eingeleitet, gefolgt von einer Chemokin-vermittelten Aktivierung der Leukozyten, einem langsamen Rollen, einer festen Adhäsion und dem „Arrest“ von Leukozyten, einer Verstärkung der Adhäsion durch chemische Ligation von Integrinen sowie dem Kriechen von Leukozyten und deren Transmigration.
Wichtige molekulare Akteure in diesen Adhäsionsprozessen sind unter anderem Selektine und deren Glykoprotein-Liganden, Chemokine und deren Rezeptoren, Integrine und Adhäsionsrezeptoren aus der Immunglobulinfamilie. Eine entscheidende Rolle im Verlauf der Kaskade kommt α4- und β2-Integrinen zu. Die Aktivierung der Integrine erfolgt nach einer Chemokin-vermittelten Signalgebung (Inside-Out-Signalgebung) im Zusammenspiel mit Selektin-aktivierten Signalwegen. Aktivierte Integrine sind am langsamen Rollen, einer festen Adhäsion, dem Kriechen und der transendothelialen Migration beteiligt. [10]
Die Mutation im ITGB2-Gen (charakteristisch für LAD-I) verursacht eine Fehlfunktion von β2-Integrin, das nicht länger seine Rolle in der Kaskade der Leukozytenadhäsion erfüllen kann.
Klinische Manifestation der verschiedenen LAD-Subtypen
Die ersten LAD-Symptome treten im Säuglingsalter oder der frühen Kindheit auf. [5]
Bei Patienten mit LAD-I kommt es häufig zu lebensbedrohlichen, wiederkehrenden (bakteriellen oder mykotischen) Infektionen der Atemwege, Haut und Schleimhäute. Ein wichtiges Charakteristikum von LAD-I ist das Fehlen typischer Zeichen einer Entzündung, wie Schwellungen, Rötungen oder Eiterbildung am Infektionsort. Andere Anzeichen des Vorliegens eines LAD-I sind unter anderem ein verspätetes Abfallen der Nabelschnur (nach dem 14. Lebenstag), das dann häufig mit einer Infektion des Nabelschnurstumpfs und einer verzögerten Wundheilung einhergeht. [5, 11]
Mutationen im SLC35C1-Gen (11p11.2), das für den im Golgi-Apparat lokalisierten Guanosin-5'-diphosphat(GDP)-Fucose-Transporter codiert, führt zum klinischen Bild des LAD-II. Dieser spezielle Fucose-Transporter überführt GDP-Fucose aus dem Zytosol in den Golgi-Apparat, wo es als Substrat für die Fucosylierung dient. Der Defekt im Zuckertransporter führt zu einer beeinträchtigten Glykosylierung von Selektin-Liganden, was sich wiederum auf die Rekrutierung und das Rollen von Leukozyten auswirkt. Patienten mit LAD-II leiden auch häufig unter wiederkehrenden bakteriellen Infektionen. Diese sind allerdings häufig weniger schwer als die bei LAD-I auftretenden Infektionen. Das klinische Bild ist charakterisiert durch einen frühen Zahnverlust aufgrund einer schweren Parodontitis sowie intellektuellen Beeinträchtigungen und einer Wachstumsverzögerung. Patienten mit LAD-II fehlen die Blutgruppenantigene H, Lewis, Lea und Leb. [5, 9, 11]
Die Mutation im FERMT3-Gen (11q13.1) führt bei Patienten mit LAD-III bei normaler Integrin-Expression zu einem Defekt bei der Aktivierung aller β-Integrine (β1, β2 und β3). Dies verursacht ein klinisches Bild, das identisch ist mit dem von Patienten mit LAD-I. Darüber hinaus können infolge der Fehlfunktion des β3-Integrins Thrombozyten nicht mehr an die Gefäßwand binden, was zu Blutungsepisoden ähnlich derer führt, die für Patienten mit einer Glanzmann-Thrombasthenie (GT) typisch sind. Diese Patienten neigen im Vergleich zu gesunden Menschen zu längeren Blutungsepisoden und leiden häufiger unter Nasen- und Zahnfleischbluten sowie Blutergüssen. [4, 5, 6, 7, 8, 11] Bislang wurden weniger als 40 Fälle von LAD-III berichtet. [12]
Diagnose von LAD und seiner Subtypen
Bei der Diagnosestellung von LAD werden der individuelle und der familiäre Hintergrund des Patienten sowie die Zellzahl im Blut und die Funktion und Glykoproteine der Zelloberfläche von Thrombozyten betrachtet. Eine endgültige Diagnose erhält man immer mit einer genetischen Untersuchung. [13]
Die Diagnose von LAD-I basiert auf einem quantitativen großen Blutbild mit Nachweis einer neutrophilen Leukozytose. Eine verringerte Expression von β2-Integrin (CD11, CD18) wird mittels Durchflusszytometrie nachgewiesen. Der Nachweis von ITGB2-Mutationen bestätigt die Diagnose. [13]
Die Diagnose von LAD-II basiert auf klinischen Befunden und einem großen Blutbild mit Nachweis einer neutrophilen Leukozytose. Für den Nachweis der Bombay-Blutgruppe ist eine Blutgruppenbestimmung unabdingbar. Der Bombay-Phänotyp ist selten in der Allgemeinbevölkerung, kann aber bei LAD-II immer nachgewiesen werden. Die endgültige Diagnose basiert auf einem genetischen Nachweis von Mutationen im SLC35C1-Gen (11p11.2). [9, 13]
Die Diagnose von LAD-III basiert auf klinischen Befunden und einem großen Blutbild mit Nachweis einer neutrophilen Leukozytose. Für die weitere Diagnostik werden Thrombozytenaggregationstests mittels Lichttransmissions-Aggregometrie (LTA) unter Verwendung der in Tabelle 1 aufgeführten Agonisten durchgeführt und die Glykoproteine auf der Zelloberfläche mittels Durchflusszytometrie (siehe Tabelle 2) untersucht. [13] Die Unterscheidung einer quantitativen GT (Typ I und II) von LAD-III erfordert die Quantifizierung der Expression von Glykoproteinen auf Thrombozyten mittels Durchflusszytometrie.
Tabelle 1 Thrombozytenaggregation bei LAD-III geordnet nach Agonist [14]
| Agonist | Ergebnis |
| Epinephrin | verringerte/fehlende Aggregation |
| ADP | verringerte/fehlende Aggregation |
| Kollagen | verringerte/fehlende Aggregation |
| α-Thrombin | verringerte/fehlende Aggregation |
| TRAP6 | verringerte/fehlende Aggregation |
| U46619 | verringerte/fehlende Aggregation |
| CRP | verringerte/fehlende Aggregation |
| Convulxin | verringerte/fehlende Aggregation |
| PAR-4 ap | verringerte/fehlende Aggregation |
| PAF | verringerte/fehlende Aggregation |
| A23187 | verringerte/fehlende Aggregation |
| Ristocetin | normale Reaktion |
Tabelle 2 Nachweis von Glykoproteinen mittels Durchflusszytometrie bei Patienten mit LAD-III
| Glykoprotein | Ergebnis |
| GPIIb(CD41)-Expression | normal |
| GPIIIa(CD61)-Expression | normal |
| „aktiviertes GPIIb/IIIa“-Epitop (PAC-1) | fehlerhafte Aktivierung |
Bei Patienten mit LAD-III erfolgt die endgültige Diagnose anhand einer genetisch nachgewiesenen Mutation im FERMT3-Gen (11q13.1). [13, 14, 15]
Therapeutische Optionen
Die Behandlung von Patienten beschränkt sich primär auf die Kontrolle der Infektionen mittels Antibiotika und Antimykotika. Patienten mit LAD-III können gegebenenfalls auch Transfusionen erhalten. Aktuell können Patienten mit LAD-I und LAD-III nur mit einer hämatopoetischen Stammzelltransplantation (Knochenmarktransplantation) geheilt werden. Eine Gentherapie kann eine neue therapeutische Option für Patienten mit LAD-I sein. Hierzu laufen gerade klinische Studien. [16, 17, 18] Bei Patienten mit LAD-II kann die Immunantwort durch eine externe Zuführung von Fucose verbessert werden. [19] Diese Patienten haben im Allgemeinen eine signifikant höhere Lebenserwartung als Patienten mit LAD-I und LAD-III.
Literatur
[1] Etzioni A et al. (1992): Recurrent Severe Infections Caused by a Novel Leukocyte Adhesion Deficiency. N Engl J Med; 327: 1789–1792.
[2] Anderson DC, Springer TA. (1987): LEUKOCYTE ADHESION DEFICIENCY: An Inherited Defect in the Mac-I, LFA-l, and pI50,95 Glycoproteins. Ann Rev Med; 38: 175–194.
[3] Mathew EC, Shaw JM, Bonilla FA, Law SK, Wright DA. (2000): A novel point mutation in CD18 causing the expression of dysfunctional CD11/CD18 leucocyte integrins in a patient with leucocyte adhesion deficiency (LAD). Clin Exp Immunol; 121: 133–138.
[4] Kuijpers TW et al. (1997): Leukocyte adhesion deficiency type 1 (LAD-1)/variant: a novel immunodeficiency syndrome characterized by dysfunctional β2 integrins. J Clin Invest; 100: 1725–1733.
[5] Hanna S, Etzioni A. (2012): Leukocyte adhesion deficiencies. Annals of the New York Academy of Sciences; 1250: 50–55.
[6] McDowall A et al. (2003): A novel form of integrin dysfunction involving β1, β2, and β3 integrins. J Clin Invest; 111: 51–60.
[7] Svensson L et al. (2009): Leukocyte adhesion deficiency-III is caused by mutations in KINDLIN3 affecting integrin activation. Nat Med; 15(3): 306–312.
[8] Meller J et al. (2012): Novel aspects of Kindlin-3 function in humans based on a new case of leukocyte adhesion deficiency III. J Thromb Haemost; 10: 1397–1408.
[9] Hidalgo A et al. (2003): Insights into leukocyte adhesion deficiency type 2 from a novel mutation in the GDP-fucose transporter gene. Blood; 101(5): 1705–1712.
[10] Mitroulis I et al. (2015): Leukocyte integrins: Role in leukocyte recruitment and as therapeutic targets in inflammatory disease. Pharmacol Ther; 147: 123–135.
[11] Harris ES, Weyrich AS, Zimmerman GA. (2013): Lessons from rare maladies: leukocyte adhesion deficiency syndromes. Curr Opin Hematol; 20(1): 16–25.
[12] Saultier P, Szepetowski S, Canault M et al. (2018): Long-term management of leukocyte adhesion deficiency type III without hematopoietic stem cell transplantation. Haematologica; 103(6): e264–e267.
[13] Etzioni A. (2007): Leukocyte Adhesion Deficiencies: Molecular Basis, Clinical Findings, and Therapeutic Options. In: Shurin MR, Smolkin YS. (eds.) Immune-Mediated Diseases. Advances in Experimental Medicine and Biology. Vol. 601; Springer, New York, NY.
[14] Gresele P for the Subcommittee on Platelet Physiology. (2015): Diagnosis of inherited platelet function disorders: guidance from the SSC of the ISTH. J Thromb Haemost; 13: 314–322.
[15] Manukjan G et al. (2020): Novel variants in FERMT3 and RASGRP2—Genetic linkage in Glanzmann-like bleeding disorders. Pediatr Blood Cancer; 67: e28078.
[16] Almarza E et al. (2019): Gene Therapy for Lad-I Immunodeficiency: Preclinical Evaluation of HSC Transduction Under Optimized GMP-Conditions. Blood; 134 (Supplement_1): 5751.
[17] Mesa-Núñez C et al. (2022): Preclinical safety and efficacy of lentiviral-mediated gene therapy for leukocyte adhesion deficiency type I. Molecular Therapy - Methods & Clinical Development; 26: 459–470.
[18] Kohn DB et al. (2021): A Phase 1/2 Study of Lentiviral-Mediated Ex-Vivo Gene Therapy for Pediatric Patients with Severe Leukocyte Adhesion Deficiency-I (LAD-I): Interim Results. Blood; 138 (Supplement_1): 2932.
[19] Marquardt T et al. (1999): Correction of Leukocyte Adhesion Deficiency Type II with Oral Fucose. Blood; 94(12): 3976–3985.