Scientific Kalender Mai 2022
Zelluläre Atypien im Urin als ein Indikator für Harnblasenkrebs
Richtig oder falsch? Harnblasenkrebs...
betrifft am häufigsten Personen unter 30 Jahren.
ist eine der häufigsten Krebsarten bei Männern.
wird einfach mit Chemotherapie allein behandelt.
hat keine hohe Rezidivrate.
wird hauptsächlich durch Rauchen verursacht.
erfordert nach der Behandlung eine engmaschige Überwachung mittels Zystoskopie.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Wissenschaftliche Hintergrundinformationen
Harnblasenkrebs
Harnblasenkrebs ist die sechsthäufigste Krebsart bei Männern mit einem Durchschnittsalter von 69 Jahren bei Diagnose. Der wichtigste Risikofaktor für die Entwicklung von Harnblasenkrebs ist das Rauchen. So können bei Männern bis zu 65 % und bei Frauen bis zu 30 % aller Fälle darauf zurückgeführt werden. Weitere Risikofaktoren sind unter anderem eine Exposition gegenüber Chemikalien, eine Prädisposition basierend auf ethnischer Zugehörigkeit und Geschlecht, eine medizinische und familiäre Anamnese von Harnblasenkrebs, eine frühere Krebsbehandlung, wiederkehrende Blasenentzündungen und das Trinken von mit Arsen verunreinigtem Brunnenwasser [1].
Im Allgemeinen unterscheidet man bei Harnblasenkrebs zwischen nicht-muskelinvasivem (non-muscle invasive bladder cancer, NMBC) und muskelinvasivem Harnblasenkrebs (muscle invasive bladder cancer, MIBC). NMIBC (Stadien 0 und 1) beginnen als Carcinoma in situ: Urothelzellen der Harnblase degenerieren und entwickeln sich zu einem papillären Tumor, der in das Lumen der Harnblase hineinreicht, aber auf das Urothel und die darunterliegende Lamina propria begrenzt ist. Bei einem MIBC kommt es zuerst zu einer Invasion des Tumors in die Muskelschicht (Stadium 2) und zu einer weiteren Ausbreitung in die Fettschicht und das Reproduktionsgewebe (Stadium 3a) sowie in die proximal gelegenen Lymphknoten (Stadium 3b). Im letzten Stadium breiten sich die Tumorzellen über den ganzen Körper aus und bilden Metastasen (Stadium 4) [2]. Die Überlebensprognose für Personen mit der Diagnose Harnblasenkrebs hängt stark vom Zeitpunkt der Diagnose ab und verschlechtert sich mit einer Progression hin zu invasiveren Krebsstadien [3].
Da es keine Standardprogramme für das Screening auf Harnblasenkrebs für Personen aus Risikogruppen gibt, ist dieser Krebs häufig ein Zufallsbefund im Zusammenhang mit harnblasenbedingten Symptomen, wie Schmerzen im Abdomen und Makrohämaturie. Zu den häufigsten diagnostischen Techniken gehören unter anderem Urinzytologie und die Zystoskopie, gefolgt von neueren Bildgebungsverfahren, Histopathologie und molekularer Diagnostik. Die Urinzytologie beinhaltet eine mikroskopische Untersuchung von mit Papanicolaou oder anderen, ähnlichen Farbstoffen gefärbten Zellen im Urin (kurz auch PAP-Test genannt). Die Zystoskopie hingegen ist ein invasives, endoskopisches Verfahren zur Untersuchung des Urothels der Harnblase [4].
Die Behandlungsoptionen bei Harnblasenkrebs hängen von verschiedenen Parametern ab, wie unter anderem dem Krebsstadium bei Diagnose, der Größe und Lage des Tumors sowie der Tumorgenetik. Somit reichen die Behandlungsoptionen von einer transurethalen Resektion (TURBT), Chemotherapie, Radiotherapie und Immuntherapie bis hin zu einer radikalen Zystektomie. Häufig werden diese Optionen im Rahmen eines multimodalen Ansatzes kombiniert [4,5].
NIMBC hat mit bis zu 60 % im ersten Jahr und bis zu 70 % im fünften Jahr nach der Behandlung eine hohe Rezidivrate. Daher wird eine engmaschige Überwachung in Form vierteljährlicher Zystoskopien empfohlen [6].
Atypische Zellen in der UF-Serie
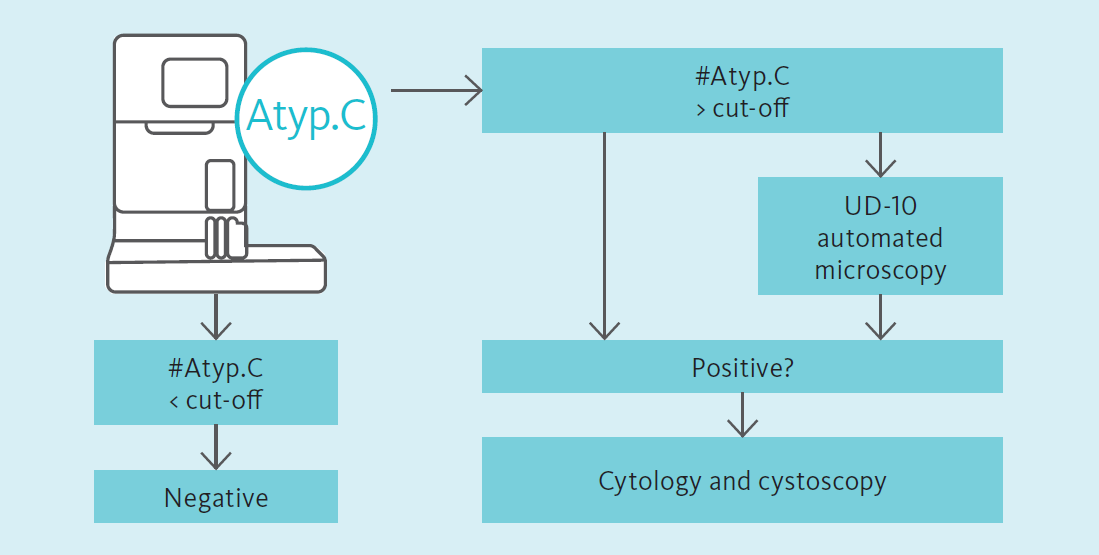
Die UF-Serie weist in Urinproben mittels Fluoreszenz-Durchflusszytometrie atypische Zellen (atyp.Z) nach, die von nicht-atypischen Zellen differenziert werden können. Atypische Zellen werden aus dem Urothel abgegeben und weisen Änderungen auf, die ein Malignom vermuten lassen. Zu diesen Änderungen gehören auch vergrößerte Nuklei, ein erhöhtes N/C-Verhältnis (Anzahl der Nukleoli pro Zelle) und eine höhere Anzahl an Nukleoli [7].
Das Potenzial des atyp.Z-Parameters für einen Nachweis von Harnblasenkrebs wird derzeit wissenschaftlich untersucht. Aydin et al. [8] haben im Falle eines rezidivierenden, hochgradigen Urothelkarzinoms in ambulanter Umgebung das Potenzial der UF-Serie in Kombination mit dem UD-10 für den Nachweis eines solchen Karzinoms gezeigt. Tınay et al. [9] haben das Potenzial von atyp.Z im Hinblick auf diagnostische Entscheidungen im Zusammenhang mit der Überwachung von Harnblasenkrebs bei Patienten mit anamnestisch bekanntem Harnblasenkrebs, insbesondere bei NIMBC mit niedrigem Risiko, gezeigt und geschlussfolgert, dass die Verwendung des atyp.Z-Parameters potenziell dazu führen kann, dass sich ein Patient weniger häufig invasiven Zystoskopien unterziehen muss. Für Patienten mit einem vermuteten Urothelkarzinom konnten Ren et al. zeigen, dass [10] der prädiktive Wert des atyp.Z-Parameters gut mit zytopathologischen Befunden korreliert. Die Autoren schlussfolgerten, dass dieser Parameter im Kontext einer routinemäßigen Urindiagnostik als unterstützender Test auf ein Urothelkarzinom verwendet werden kann.
Haftungsausschluss:
Der atyp.Z-Parameter dient ausschließlich zu Forschungszwecken.
Numerische Ergebnisse
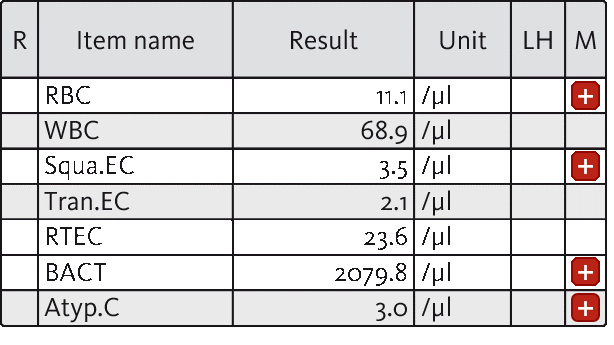
Im vorliegenden Fall wurde ein 69-jähriger Mann mit Symptomen einer Harnwegsinfektion einschließlich Fieber und Dysurie in einer Klinik vorstellig. Zur Abklärung der Symptomatik wurde zuerst eine Urinanalyse angeordnet. Nach der Untersuchung einer Urinprobe auf dem UF-5000 wurde die vermutete Harnwegsinfektion durch den Nachweis von 2.079,8 Bakterienzellen pro µl mit begleitender leichter Hämaturie und Leukozyturie bestätigt.
Darüber hinaus ergab die Laboruntersuchung das Vorliegen von 3,0 atyp.Z pro µl. Eine mikroskopische Untersuchung mit Verwendung des UD-10 bestätigte das Vorliegen atyp.Z mit großen Nuklei und prominenten Nukleoli. Basierend auf diesen Befunden wurde eine Zystoskopie durchgeführt, deren Ergebnisse die Befunde der Urinanalyse unterstützten und zur Diagnose von Harnblasenkrebs führten.
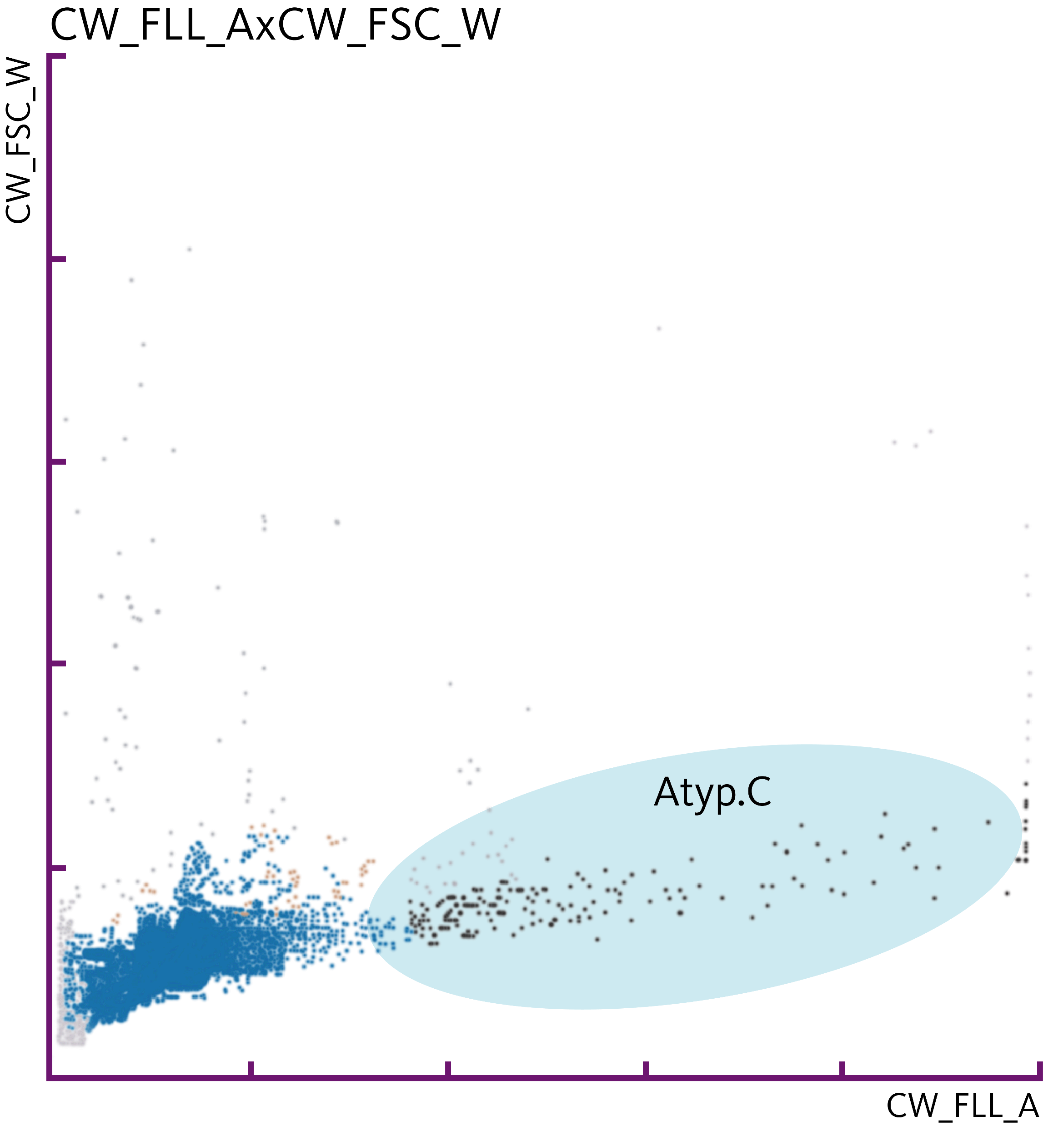
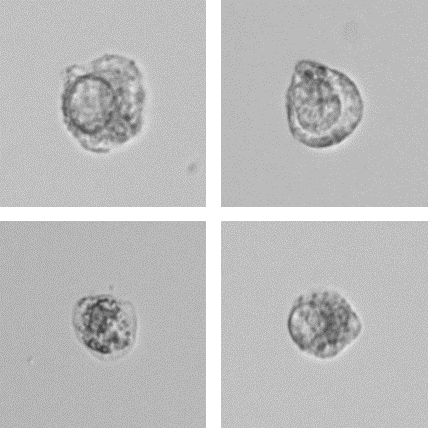
Fazit
Die Urin-Durchflusszytometrie kann potenziell im Zusammenhang mit einem Urothelkarzinom maligne Zellen nachweisen und könnte für den Nachweis von Harnblasenkrebs und insbesondere bei der Überwachung von Patienten mit bekanntem Harnblasenkrebs eingesetzt werden, bei denen das Verfahren atypische Zellen im Urin erkennt. Diese Forschung dient dazu, dass sich solche Patienten in Zukunft weniger oft invasiven Zystoskopien unterziehen müssen.
Literatur
[1] Torre LA et al. (2015): Global cancer statistics, 2012. CA Cancer J Clin 65(2):87–108.
https://pubmed.ncbi.nlm.nih.gov/25651787/#:~:text=Based%20on%20GLOBOCAN%20estimates%2C%20about,65%25%20of%20cancer%20deaths%20worldwide.
[2] Sanli O et al. (2017): Bladder cancer. Rev Dis Primers 3:17022. https://pubmed.ncbi.nlm.nih.gov/28406148/
[3] Ripoll J et al. (2021): Cancer-specific survival by stage of bladder cancer and factors collected by Mallorca Cancer Registry associated to survival. BMC Cancer 21:676. https://bmccancer.biomedcentral.com/track/pdf/10.1186/s12885-021-08418-y.pdf
[4] Lenis AT et al. (2020): Bladder CANCER – a Review: JAMA 324(19):1980–1991. https://pubmed.ncbi.nlm.nih.gov/33201207/
[5] Ploussard G et al. (2014): Critical Analysis of Bladder Sparing with Trimodal Therapy in Muscle-invasive Bladder Cancer: A Systematic Review. Eur Urol 66(1):120–137. https://pubmed.ncbi.nlm.nih.gov/24613684/
[6] van der Heijden and Witjes (2009): Recurrence, Progression, and Follow-Up in Non-Muscle-Invasive Bladder Cancer. European Urology Supplements 8:556–562. https://www.sciencedirect.com/science/article/abs/pii/S1569905609000578?via%3Dihub
[7] Mokhtar A et al. (2010): Diagnostic significance of atypical category in the voided urine samples: A retrospective study in a tertiary care center. Urol Ann 2(3):100–106. https://pubmed.ncbi.nlm.nih.gov/20981196/
[8] Aydin O (2021): Atypical cells parameter in Sysmex UN automated urine analyzer: feedback from the field. Turk J Biochem; Diagnostic Pathology 16:9. https://diagnosticpathology.biomedcentral.com/track/pdf/10.1186/s13000-021-01068-5.pdf
[9] Tınay İ et al. (2020): “Atypical Cell” Parameter in Automated Urine Analysis for the Diagnosis of Bladder Cancer: A Retrospective Pilot Study. Bull Urooncol 19(1):17–19. http://cms.galenos.com.tr/Uploads/Article_36890/UOB-19-17-En.pdf
[10] Ren C et al. (2020): Investigation of Atyp.C using UF-5000 flow cytometer in patients with a suspected diagnosis of urothelial carcinoma: a single-center study. Diagn Pathol 15(1):77. https://diagnosticpathology.biomedcentral.com/track/pdf/10.1186/s13000-020-00993-1