Scientific Kalender August 2023
Genaues Monitoring der Therapie bei Hämophilie
Welches APTT-Reagenz sollte beim Monitoring einer Therapie mit Esperoct nicht verwendet werden?
Die Wahl des APTT-Reagenzes ist in keiner Form eingeschränkt. Für das Monitoring der Therapie mit Esperoct kann jedes Reagenz, egal ob auf Basis von Siliciumdioxid, Ellagsäure oder Kaolin, verwendet werden.
Die meisten auf Siliciumdioxid-basierenden APTT-Reagenzien können zu einer Unterschätzung der Konzentration von infundiertem Esperoct führen. Die Wahl des APTT-Reagenzes hängt daher von dem spezifischen Produkt ab.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Hintergrund
Während die Hämophilie als solche schon seit vielen Jahrhunderten bekannt ist und von verschiedenen Gelehrten beschrieben wurde, ist die Geschichte einer erfolgreichen Behandlung noch relativ jung. Zu den ersten Behandlungsoptionen gehörte lediglich die akute Behandlung auftretender Blutungen durch die Verabreichung von Vollblutspenden von Verwandten und, nach Entdeckung der Gerinnungsfaktoren, die Transfusion von Plasma. Allerdings konnte diese Art der Behandlung noch nicht Blutungen vorbeugen. Dies änderte sich erst in den 1960er Jahren, als Judith G. Pool entdeckte, dass Kryopräzipitate von Plasma große Mengen Faktor VIII (FVIII) enthalten. Diese Kryopräzipitate wurden in den frühen Jahren weiterhin für die Behandlung auftretender Blutungen verwendet. Diese Entdeckung legte aber auch den Grundstein für eine präventive Therapie, die erstmals in der zweiten Hälfte der 1980er Jahre mit der Entwicklung von rekombinanten Faktor-Konzentraten möglich wurde. [1, 2]
In den letzten Jahren hat die Entwicklung von Präparaten für die Therapie von Hämophilie eine Eigendynamik entwickelt. Verfügbare therapeutische Optionen beruhen nun auf neuen rekombinanten Produkten mit einer verlängerten Halbwertszeit (extended half-life, EHL; basierend auf der Modifikation des entsprechenden Gerinnungsfaktors), einer Modifikation des Gerinnungsfaktors durch die Fusion der Fc-Region des IgG1-Immunglobulins oder von Albumin oder das Hinzufügen von Polyethylenglykol (PEG) in unterschiedlichen Molekulargewichten. [3] Zudem gewinnen Therapiestrategien, die keine Faktorersatztherapie darstellen, zunehmend an Bedeutung. Zum Beispiel ist Emicizumab ein humanisierter monoklonaler bispezifischer Antikörper für die Behandlung von Hämophilie A (HA). Die eine Hälfte des Antikörpers bindet an den aktivierten Gerinnungsfaktor IX (FIXa) und die andere Hälfte an den Gerinnungsfaktor X (FX). Somit ahmt der Antikörper die Funktion des aktivierten Faktors VIII (FVIIIa) nach, der bei HA-Patienten fehlt oder kaum vorhanden ist. [4] Eine weitere Option zur Behandlung von Hämophilie-Patienten ist die Gentherapie. Hierbei wird eine vollständige funktionelle Kopie des Gerinnungsfaktor-Gens, das bei Hämophilie defekt ist, mittels genetisch modifizierter Viren (für gewöhnlich Adeno-assoziierte Viren [AAV]) in den Körper des Patienten eingeschleust. Das Einschleusen des Gens in Endothelzellen und Sinusoid-Zellen der Leber wird durch einen speziellen Promoter gesteuert. Im Idealfall kann der Körper des Patienten selbstständig ausreichende Mengen an Gerinnungsfaktor herstellen. [5]
Im Hinblick auf das Vermeiden von unerwünschten Blutungen und Langzeitfolgeschäden ist für Hämophilie-Patienten ein zuverlässiges und genaues Monitoring der Behandlung sehr wichtig.
Für die Bestimmung von FVIII- und FIX-Spiegeln gibt es einstufige und zweistufige Gerinnungstests sowie chromogene Tests (chromogenic assays, CSA). Es ist weithin bekannt, dass es Unterschiede bei den Ergebnissen der verschiedenen Tests für hereditäre Hämophilie, und hier insbesondere bei den leichten Formen, gibt. [6, 7, 8, 9, 10] Das gleiche gilt für die Ergebnisse des Monitorings einer Therapie mit humanen Faktor-Konzentraten und vollständigen rekombinanten Produkten, obgleich einstufige Gerinnungstests und chromogene Tests grundsätzlich ein genaues Monitoring der Therapie erlauben. Mit der Entwicklung neuer rekombinanter EHL-Gerinnungsfaktoren und den sogenannten Nicht-Faktor-Ersatztherapien ergeben sich für das Labor neue Herausforderungen, da es für das Monitoring der Therapie einen Test nutzen sollte, der Ergebnisse basierend auf der Kennzeichnung des Produkts nahe an den berechneten Behandlungswerten liefert.
Unterschiede bei den Ergebnissen verschiedener einstufiger APTT-basierter Faktor Tests (one-step APTT-based factor, OSA) werden mehreren Faktoren zugeschrieben. Ein Aspekt hierbei ist die Wahl des APTT-Reagenzes zur Ermittlung der Faktoraktivität. APTT-Reagenzien unterscheiden sich hinsichtlich der verwendeten Phospholipide (pflanzlichen oder tierischen Ursprungs oder rekombinant) und deren Konzentration sowie der Wahl des Aktivators. Darüber hinaus hat die Wahl des Plasmas ohne Faktor (z. B. die Konzentration des von-Willebrand-Faktors [VWF] in Plasma ohne Faktor VIII oder nur mit Restaktivität) ebenso einen kritischen Einfluss auf die Bestimmung der Faktor-Konzentration bei Hämophilie-Patienten. Andere Faktoren, die die Qualität des Monitoring der Hämophilie-Therapie beeinflussen können, sind die Wahl des Kalibrators (in einigen Fällen werden testspezifische Kalibratoren empfohlen), das Analysegerät und die Testprotokolle (Analysen mit nur 1 Verdünnung oder Analysen mit mehreren Verdünnungen und Linearität des Tests). [10, 11, 12]
Wie oben erwähnt, gibt es Diskrepanzen bei der Ermittlung der Faktoraktivität zwischen OSA- und CSA-Tests, wenn diese für Patienten mit einer leichten Form der Hämophilie verwendet werden. [6, 7, 8, 9, 10] Im Allgemeinen sind die mit OSA-Tests erhaltenen Ergebnisse höher als die mit CSA-Tests. Dies gilt insbesondere für Patienten mit einer leichten Form der Hämophilie. Allerdings kann auch das Gegenteil zutreffen: Das Ergebnis eines chromogenen Tests entspricht einer leichten Hämophilie, aber das klinische Bild sagt etwas anderes. [13]
Ein weiterer Faktor beim Monitoring der Hämophilie-Therapie, der nicht unberücksichtigt bleiben sollte, ist das Medikament selber. Für einige EHL-Medikamente werden OSA-Tests nicht empfohlen, da sie die Faktoraktivität unterschätzen. Für einige andere Medikamente gilt diese Einschränkung nur für den für das APTT-Reagenz verwendeten Aktivator. Zum Beispiel sollten für die Feststellung der infundierten FVIII-Konzentration von Esperoct (N8 GP) die meisten Siliciumdioxid-basierten APTT-Reagenzien nicht verwendet werden, weil die FVIII-Konzentration bei Verwendung dieses Reagenzes unterschätzt wird. Dies ist nicht der Fall für andere nicht-Siliciumdioxid-basierte APTT-Reagenzien. Allerdings ist anzumerken, dass individuelle Leitlinien ebenfalls einige nicht-Siliciumdioxid-basierte APTT-Reagenzien von dem Monitoring der Therapie mit Esperoct ausschließen. Für andere rekombinante Produkte ist die Wahl der Testmethode nicht wichtig, da sie korrekt sowohl mit OSA- als auch CSA-Tests gemessen werden können.
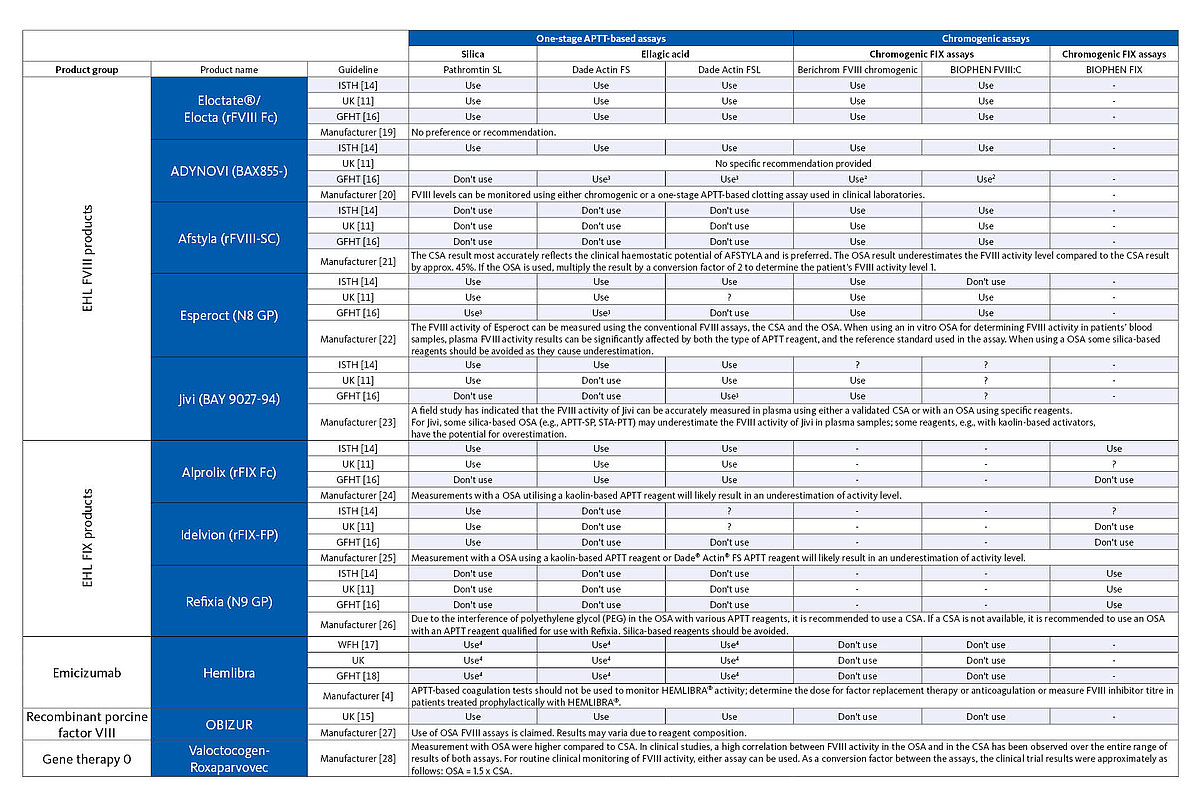
Angesichts der großen Anzahl an verschiedenen Therapieansätzen ist es für das Labor wichtig, zu wissen, welches Medikament der Hämophilie-Patient erhält, um danach die geeignetste Messmethode für das Monitoring der Therapie auszuwählen. Die nachfolgende Tabelle enthält eine Übersicht über die Testsysteme, die gemäß den Anweisungen des Herstellers als auch nach Meinung von Experten für das Monitoring der verschiedenen Therapieoptionen bei Hämophilie verwendet werden sollten.
1 Wird von einigen Leitlinien nicht empfohlen.
2 Es wird die Verwendung eines produktspezifischen Kalibrators empfohlen.
3 Hier weichen die Ergebnisse von Studien voneinander ab. Die Leitlinie empfiehlt die Verwendung chromogener Tests. Ergebnisse müssen mit Vorsicht interpretiert oder bei Verwendung von einstufigen APTT-basierten Faktor-Tests mit den Ergebnissen chromogener Tests verglichen werden.
4 Verwendung eines modifizierten Test-Protokolls mit höherer Verdünnung der Proben und einem für Emicizumab spezifischen Kalibrator.
? Nicht speziell unterstützt oder ausgeschlossen
Literatur
[1] Schramm W. (2014): The history of haemophilia - a short review. Thromb Res. 2014 Nov;134 Suppl 1: S4-9.
[2] Franchini M, Mannucci PM. (2014): The history of hemophilia. Semin Thromb Hemost. 2014 Jul;40(5):571-6.
[3] Young G, Mahlangu JN. (2016): Extended half-life clotting factor concentrates: results from published clinical trials. 2016 Jul;22 Suppl 5:25-30.
[4] Hemlibra® (2022): Leitfaden für medizinisches Fachpersonal, Version 3.0, Stand: Dezember 2022. Roche Pharma AG.
[5] ROCTAVIAN (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[6] Bowyer AE, Van Veen JJ, Goodeve AC, Kitchen S, MakrisM. (2013): Specific and global coagulation assays in the diagnosis of discrepant mild hemophilia A. Haematologica 2013;98(12):1980–1987
[7] Baig MA, Swamy KB. (2021): Comparative analysis of chromogenic vs clot-based one stage APTT assay for determination of factor VIII level. Indian J Pathol Microbiol. 2021 Jan-Mar;64(1):123-127.
[8] Potgieter, J.J., Damgaard, M. and Hillarp, A. (2015): One-stage vs. chromogenic assays in haemophilia A. Eur J Haematol, 94: 38-44.
[9] Annette E. Bowyer, Robert C. Gosselin. (2022): Factor VIII and Factor IX Activity Measurements for Hemophilia Diagnosis and Related Treatments. Semin Thromb Hemost, available online at DOI: 10.1055/s-0042-1758870.
[10] Pouplard C, Trossaert M, Le Querrec A, et al. (2009): Influence of source of phospholipids for APTT- based factor IX assays and potential consequences for the diagnosis of mild haemophilia B. Haemophilia. 2009;15(1):365-368.
[11] Gray E, Kitchen S, Bowyer A, et al. (2020): Laboratory measurement of factor replacement therapies in the treatment of congenital haemophilia: A United Kingdom Haemophilia Centre Doctors’ Organisation guideline. Haemophilia. 2020; 26:6–16.
[12] Nougier C, Sobas F, Nguyen TK, et al. (2011): Analytic variability due to change of deficient plasma vials: application to one-stage clotting factor VIII assay. Blood Coagul Fibrinolysis 2011;22: 151–154.
[13] Bowyer AE, Goodeve A, Liesner R,Mumford AD, Kitchen S, Makris M. (2011): p.Tyr365Cys change in factor VIII: haemophilia A, but not as we know it. Br J Haematol 2011;154(5):618–625.
[14] Peyvandi F, et al. (2020): Laboratory testing in hemophilia: Impact of factor and non-factor replacement therapy on coagulation assays. J Thromb Haemost.; 18: 1242–1255.
[15] Bowyer A, Gray E, Lowe A, et al. (2022): Laboratory coagulation tests and recombinant porcine factor VIII: A United Kingdom Haemophilia Centre Doctors’ Organisation guideline. Haemophilia. 2022;1-5.
[16] Jeanpierre E, Pouplard C, Lasne D, et al; On behalf of the French Study Group on the Biology of Hemorrhagic Diseases (the BIMHO group). (2020): Factor VIII and IX assays for post-infusion monitoring in hemophilia patients: Guidelines from the French BIMHO group (GFHT). Eur J Haematol. 2020; 105:103–115.
[17] Srivastava A, et al. (2020): WFH Guidelines for the Management of Hemophilia, 3rd edition. Haemophilia: 26 (Suppl 6): 1 – 158.
[18] Nougier C, et al. (2020): Emicizumab treatment: Impact on coagulation tests and biological monitoring of haemostasis according to clinical situations (BIMHO group proposals). Eur J Haematol.; 105: 675–681.
[19] Elocta (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[20] ADYNOVI (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[21] AFSTYLA (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[22] Esperoct (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[23] Jivi (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[24] Alprolix (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[25] Idelvion (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[26] Refixia (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[27] OBIZUR (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[28] Valoctocogen-Roxaparvovec (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.