Scientific Kalender Februar 2023
EDTA-abhängige Phagozytose von Thrombozyten infolge einer zugrundeliegenden Infektion
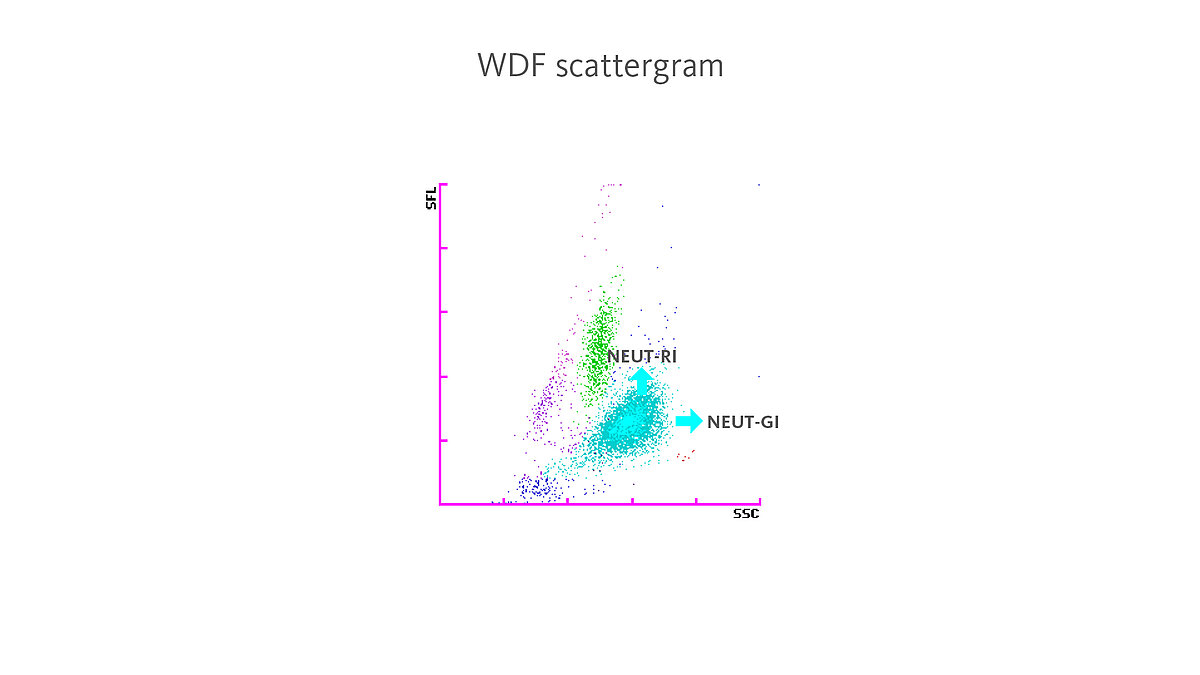
Welches Messsignal kann die Aktivierung der Neutrophilen (NEUT-RI) anzeigen?
Seitwärts-Fluoreszenzlicht (SFL)
Seitwärts-Streulicht (SSC)
Peakhöhe im PLT-Histogramm
Vorwärts-Streulicht (FSC)
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Wissenschaftliche Hintergrundinformationen
Die Strategien der Neutrophilen im Rahmen der Immunreaktion
Eine bakterielle Infektion führt im menschlichen Körper zu einem Entzündungszustand, der das angeborene Immunsystem in Gang setzt.
In der frühen Phase der Reaktion des angeborenen Immunsystems werden die Neutrophilen aktiviert. Sie agieren als eine erste, unspezifische Verteidigungslinie gegen Pathogene. Dabei wenden Sie zwei verschiedene Strategien [1] an. Eine der Strategien besteht in der Sezernierung proinflammatorischer Zytokine und Chemokine, die andere Neutrophile anlocken und hinsichtlich der Infektion andere Reaktionen des Wirts aktivieren [2].
Darüber hinaus entfernen Neutrophile Pathogene mittels Phagozytose und identifizieren Antigene zur Aktivierung der Reaktion des erworbenen Immunsystems [1]. In dieser Phase sind die Neutrophilen stark aktiviert. Ihre Granularität und metabolische Aktivität steigt. Dieser Anstieg der Färbedichte und die Anzahl der Granula in den Neutrophilen wird als „toxische Granulation“ bezeichnet. Ein anderes Anzeichen für die Aktivierung von Neutrophilen ist das Vorliegen von Vakuolen im Zytoplasma, zu der es bei einer erhöhten phagozytischen Aktivität kommt [3]. Infolge der Produktion von Chemokinen und Zytokinen weisen aktivierte Neutrophile auch eine erhöhte metabolische Aktivität im Zytoplasma auf.
Ein weiterer in aktivierten Neutrophilen zu beobachtender Mechanismus ist die Ausbildung sogenannter „Neutrophil Extracellular Traps“ (NET). Diese netzartigen Strukturen bestehen aus DNA, Histonen und Granula. NET dienen dem Einfangen und Eliminieren von Pathogenen [4].
Das Messen einer erhöhten Reaktivität und Granularität von Neutrophilen auf Hämatologie-Analysesystemen
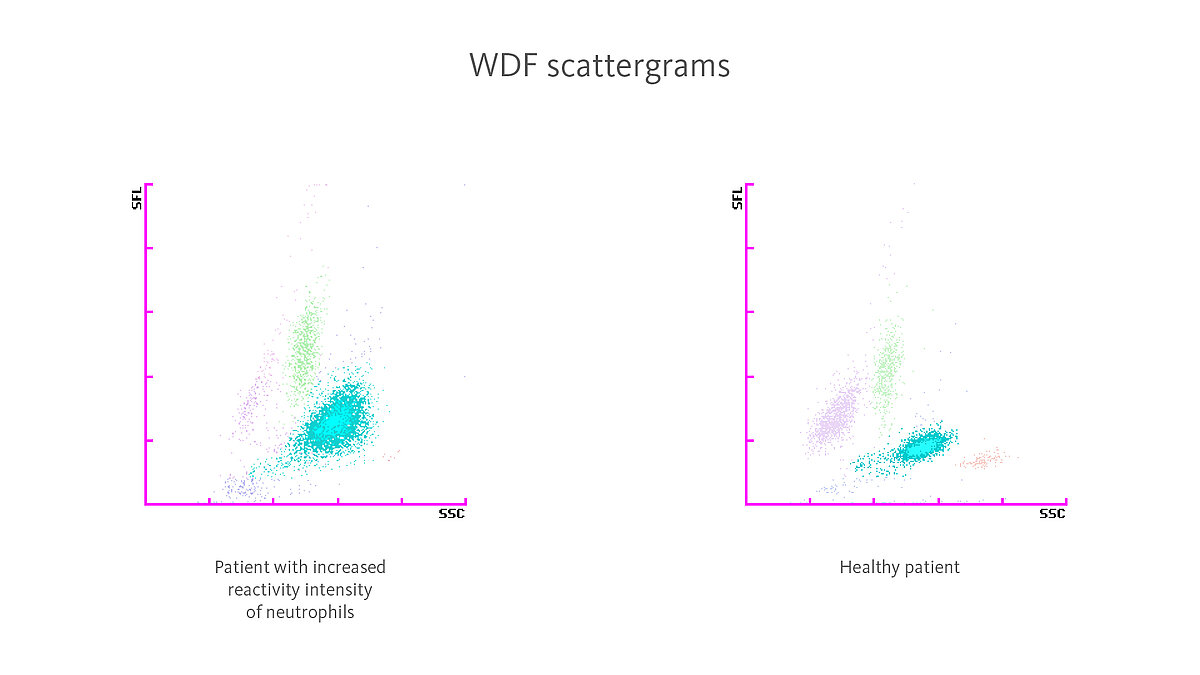
Auf Hämatologie-Analysesystemen der XN-Serie führt eine höhere Reaktivität von Neutrophilen zu einem Anstieg der Fluoreszenzintensität (SFL) im WDF-Kanal, während ein Anstieg der Granularität zu einer höheren Streulichtintensität (SSC) führt.
Mit den sogenannten „Extended Inflammation Parameters“ NEUT-RI (Reaktivitätsintensität der Neutrophilen) und NEUT-GI (Granularitätsintensität von Neutrophilen), welches beides diagnostische Parameter sind, kann dies gemessen werden.
Studien haben gezeigt, dass es speziell bei bestehenden bakteriellen Infektionen zu einem Anstieg von NEUT-RI und NEUT-GI kommt [5,6].
Das Verhalten und Schicksal von Thrombozyten bei bestimmten Grunderkrankungen
In sehr seltenen Fällen können Grunderkrankungen, wie bakterielle Infektionen oder onkologische Erkrankungen, die Bildung von Autoantikörpern gegen Thrombozyten auslösen [7]. Diese treten natürlich in etwa 0,1 % der Allgemeinbevölkerung und in bis zu 0,21 % der stationären Patienten auf [8].
Das Antikoagulans EDTA hat auf die Membranen von Thrombozyten einen chelatbildenden Effekt. Durch das Entnehmen von Ca2+-Ionen verursacht EDTA eine Konformationsänderung, wodurch kryptische Antigene auf den Glykoprotein-IIb/IIIa-Rezeptoren auf den Membranen von Thrombozyten exponiert werden. Die Autoantikörper binden dann an die exponierten Antigene, was Signalwege aktiviert, die zur Agglutination von Thrombozyten sowie zu Satellismus und Phagozytose durch Neutrophile und in selteneren Fällen zu Monozyten führen [9–11].
Dieses Geschehen, das als EDTA-abhängige Pseudothrombozytopenie bezeichnet wird, ist keine Krankheit, sondern ein in-vitro-Phänomen. Im Hinblick auf die Vermeidung einer unnötigen Behandlung und Medikamentengabe muss eine solche EDTA-abhängige Pseudothrombozytopenie unbedingt als solche erkannt werden. Da eine Pseudothrombozytopenie häufig mit Autoimmunerkrankungen oder Infektionen assoziiert ist, sollte dieser in Form einer Untersuchung auf mögliche Grunderkrankungen nachgegangen werden [9]. Durch Citrat und Heparin verursachte Pseudothrombozytopenien sind äußerst selten [12].
In diesem Falle wurde die EDTA-abhängige Pseudothrombozytopenie wahrscheinlich durch eine Infektion mit Klebsiella pneumoniae ausgelöst.
Interpretation der Ergebnisse
Im Krankenhaus wurde ein Patient vorstellig, der über allgemeines Unwohlsein und Fieber mit Erbrechen und Symptome einer Harnwegsinfektion oder Pyelonephritis klagte. Später wurde anhand einer angelegten Blutkultur eine Infektion mit Klebsiella pneumoniae bestätigt.
Die Ergebnisse eines auf einem Analysesystem der XN-Serie durchgeführten Blutbilds ergaben für weiße und rote Blutzellen Werte im Normbereich sowie eine leichte Thrombozytopenie. Es wurde ein Anstieg des Extended Inflammation Parameter NEUT-RI (NEUT-RI 65.0 FI; Referenzbereich 42,0–50,6 FI [13]) beobachtet. Außerdem wurde das Flag „PLT Clumps?“ ausgelöst.
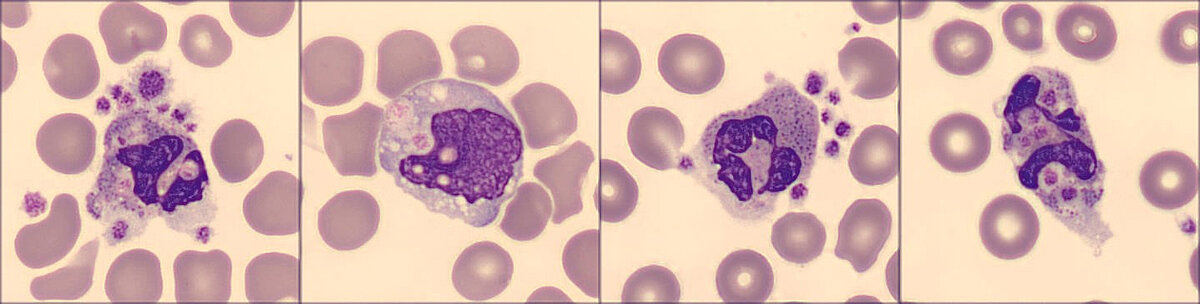
Die digitale Bildgebung eines von einer EDTA-Blutprobe erstellten Blutausstrichs zeigte eine starke Aktivierung der Neutrophilen sowie einen Thrombozyten-Satellismus und -Phagozytose durch Neutrophile und Monozyten (siehe Abb. 3). Ein Blutausstrich einer 14 Stunden später entnommenen Blutprobe zeigte weiterhin Satellismus und Phagozytose sowie eine Vakuolisierung und den Zerfall von Neutrophilen.
Eine neue mit Citrat als Antikoagulans entnommene Blutprobe zeigte weder das Satellitenphänomen noch Phagozytose.*
*) Die Verwendung von Citrat als Antikoagulans wird von Sysmex nicht unterstützt. Die möglichen Auswirkungen auf die analytische Leistungsfähigkeit muss von dem Anwender validiert werden.
Literatur
[1] Wright HL et al. (2010): Neutrophil function in inflammation and inflammatory diseases. Rheumatology. 49(9): 1618–31.
[2] Guerra FE et al. (2017): Epic Immune Battles of History: Neutrophils vs. Staphylococcus aureus. Front. Cell. Infect. Microbiol. 7: 286
[3] Zonneveld R et al. (2016): Analyzing Neutrophil Morphology, Mechanics and Motility in Sepsis: Options and Challenges for Novel Bedside Technologies. Crit Care Med. 44: 218–28.
[4] Brinkmann V et al. (2004): Neutrophil extracellular traps kill bacteria. Science. 303: 1532–5.
[5] Henriot I et al. (2016): New parameters on the hematology analyzer XN-10 (Sysmex™) allow to distinguish childhood bacterial and viral infections. Int J Lab Hematol. 39(1): 14–20.
[6] Cornet E et al. (2015): ): Contribution of the new XN-1000 parameters NEUT-RI and NEUT-WY for managing patients with immature granulocytes. Int J Lab Hematol. 37(5): e123–6.
[7] Sousa SM et al. (2020): Pseudothrombocytopenia: a case of platelet satellitism and phagocytosis by neutrophils. Platelets. 31(4): 541–3.
[8] Bartels PC et al. (1997): Screening for EDTA dependent deviations in platelet counts and abnormalities in platelet distribution histograms in pseudothrombocytopenia. Scand J Clin Lab Invest. 57(7): 629–36.
[9] Lippi G et al. (2012): EDTA-dependent pseudothrombocytopenia: further insights and recommendations for prevention of a clinically threatening artifact. Clin Chem Lab Med. 50(8): 1281–5.
[10] Tan GC et al. (2016): Pseudothrombocytopenia due to Platelet Clumping: A Case Report and Brief Review of the Literature. Case Rep Hematol. 2016:3036476.
[11] Ravel R et al. (1974): Platelet Satellitosis and Phagocytosis by Leukocytes. Lab Med. 5(6): 41–2.
[12] Sahin C et al. (2014): EDTA-induced pseudothrombocytopenia in association with bladder cancer. BMJ Case Rep. Bcr-2014-205130.
[13] L van Pelt J et al. (2022): Reference intervals for Sysmex XN hematological parameters as assessed in the Dutch Lifelines cohort. Clin Chem Lab Med. 60(6): 907–20.