Scientific Kalender November 2023
Harnwegsinfektionen – Weniger Arbeitslast bei gleichzeitig schnellerer Diagnose
Was macht Harnwegsinfektionen zu einem Treiber der antimikrobiellen Resistenz (AMR)?
zeitaufwendige Routinediagnostik
empirische Verschreibungen
HWI-bedingte Symptome (z. B. Fieber)
Übergehen der HWI-Diagnostik
Behandlung mit Phytopharmaka
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Fallgeschichte
Wissenschaftliche Hintergrundinformationen
Eine Harnwegsinfektion (HWI) ist mit etwa 400 Millionen betroffenen Personen (Männer und Frauen) weltweit eine der häufigsten bakteriellen Infektionen [R31-1]. Frauen sind von dieser Infektion besonders betroffen: Etwa 60 % aller Frauen erkranken zu irgendeinem Zeitpunkt in ihrem Leben an einer HWI [R31-2] und 30–45 % der Frauen entwickeln eine rezidivierende HWI. Letztere ist definiert als eine entweder in den drei Monaten oder in dem nachfolgenden Jahr nach der primären Infektion auftretende weitere Infektion [R31-3].
Die Prävalenz der HWI trägt signifikant zu den Auswirkungen dieser Infektion auf die Gesundheitssysteme und Gesellschaften bei, da HWI-Infektionen (1) der Grund für Millionen Arztbesuche jährlich sind [R31-4], (2) zu einer hohen Arbeitslast für klinische Labore führen [R31-5] und (3) in den USA und Europa etwa 15 % aller Antibiotika-Verschreibung ausmachen [R31-6]. Ein großer Teil dieser Antibiotika-Verschreibungen erfolgt empirisch ohne angemessene Diagnostik [R31-7]. Somit gelten HWI als ein starker Treiber der antimikrobiellen Resistenz (AMR) [R31-8]. Eine angemessene HWI-Diagnostik könnte die sogenannte Antimikrobielle Stewardship (AMS) unterstützen, indem unnötige Antibiotika-Verschreibungen vermieden und schnelle und zielgerichtete Behandlungen unterstützt werden.
Harnwegsinfektionen – Weniger Arbeitslast bei gleichzeitig schnellerer Diagnose
Harnwegsinfektionen (HWI) verursachen in diagnostischen Laboren signifikante Arbeitslasten, wobei bis zu 80 % der Proben nachweislich negativ für eine HWI sind. Die klassische HWI-Diagnostik ist ein längeres Verfahren, da Urinkulturen angelegt und bakterielle Suszeptibilitätstests für Antibiotika durchgeführt werden müssen. Folglich werden häufig empirisch Antibiotika verschrieben, was den Anstieg antimikrobieller Resistenzen begünstigt [R32-1].
Verschiedene Untersuchungen der analytischen Leistungsfähigkeit haben das Potenzial der UF-Serie zum Ausschluss einer HWI anhand des Fehlens einer Bakteriämie belegt. Die Nutzung dieses Geräts kann sich potenziell auf Arbeitsabläufe und Arbeitsbelastungen (Durchführen von mikrobiologischen Tests) auswirken [z. B. R32-3]. Bei der großen Mehrheit der Proben mit vermuteter HWI kann keine Bakteriämie nachgewiesen werden. Dies legt das Nichtvorliegen einer bakteriellen HWI nahe, wodurch keine weiteren diagnostischen Verfahren für diese Proben (Urinkulturen) erforderlich sind.
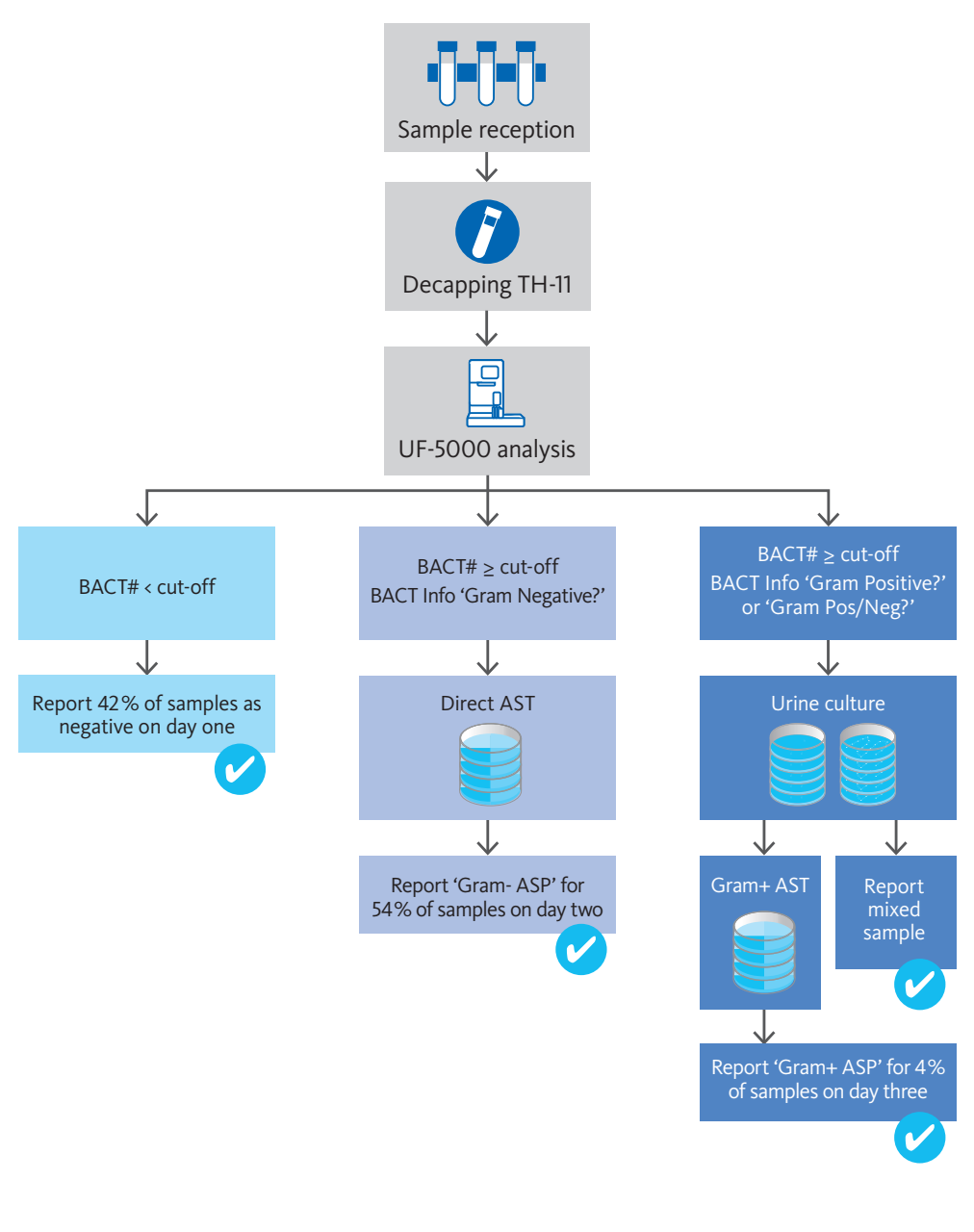
Gilboe et al. [R32-3] haben das signifikante Potenzial einer Kombination der Bakterienzahl und der Leukozytenzahl für den Ausschluss einer HWI nachgewiesen. Hier können etwa 42 % aller Proben mit einer vermuteten HWI direkt am Tag des Erhalts der Probe als „negativ“ berichtet werden (Abb. 1, links).
Darüber hinaus wurde auch die potenzielle Auswirkung der Flag „BACT Info“ im Hinblick auf eine Verbesserung der Arbeitsabläufe und Berichtszeiten untersucht. In diesem Zusammenhang ermöglicht die Leistung der Flag „Gram negative?“ den Verzicht auf das Anlegen von Urinkulturen und unterstützt den Ansatz, sofort Suszeptibiltitätstests durchzuführen. Dies verkürzt für HWI-positive Proben mit gram-negativer Bakteriämie die Berichtszeit für antibiotische Suszeptibilitätsprofile (ASP). Insgesamt kann für 53 % aller HWI-Proben am Tag nach dem Probeneingang ein ASP berichtet werden (Abb. 1, Mitte).
Eine vollständige Diagnostik (einschließlich Urinkulturen) war nur für HWI-positive Proben mit einer gram-positiven Bakteriämie („Gram-positive?“) oder gemischten Populationen („Gram pos/neg?“) erforderlich. Dies betrifft nur eine Minderheit der vermuteten HWI-Fälle. Lediglich für 5 % der Proben kann erst zwei Tage nach Probeneingang ein ASP berichtet werden (Abb. 1, rechts).
Diese Untersuchung unterstreicht das Potenzial der UF-Serie im Hinblick auf eine Verringerung der Arbeitsbelastung (kein Anlegen von Urinkulturen) sowie eine Verbesserung der Effizienz des Arbeitsablaufes und der Berichtszeiten durch die Nutzung eines schnellen Diagnostik-Ansatzes.
Zu sehen im Bild des Kalenders: Infektion der oberen Harnwege
Eine Infektion der oberen Harnwege resultiert aus einem Aufsteigen der Pathogene aus der Harnblase in die Harnleiter und die Nieren. Abhängig vom Fortschreiten der Infektion der oberen Harnwege wird zwischen Urethritis, Pyelonephritis und Nephritis differenziert. Auch wenn eine Infektion der oberen Harnwege nicht als solche als eine komplizierte HWI definiert ist, ist doch die Unterscheidung einer Infektion der oberen und der unteren Harnwege von klinischer Relevanz, da eine Beteiligung der Nieren mit schweren Komplikationen und klinischen Ergebnissen korreliert [R33-1].
Mit 13 (Frauen) bzw. 3 (Männer) Fällen pro 10.000 HWI-Fällen ist die Inzidenz der Infektion der oberen Harnwege deutlich kleiner als die einer Infektion der unteren Harnwege [R33-2] und geht mit zusätzlichen und schwereren Symptomen (wie Schmerzen und Beschwerden in den Flanken, im unteren Rücken oder rund um die Genitalien, Fieber, Schüttelfrost, Erschöpfung und Durchfall) einher.
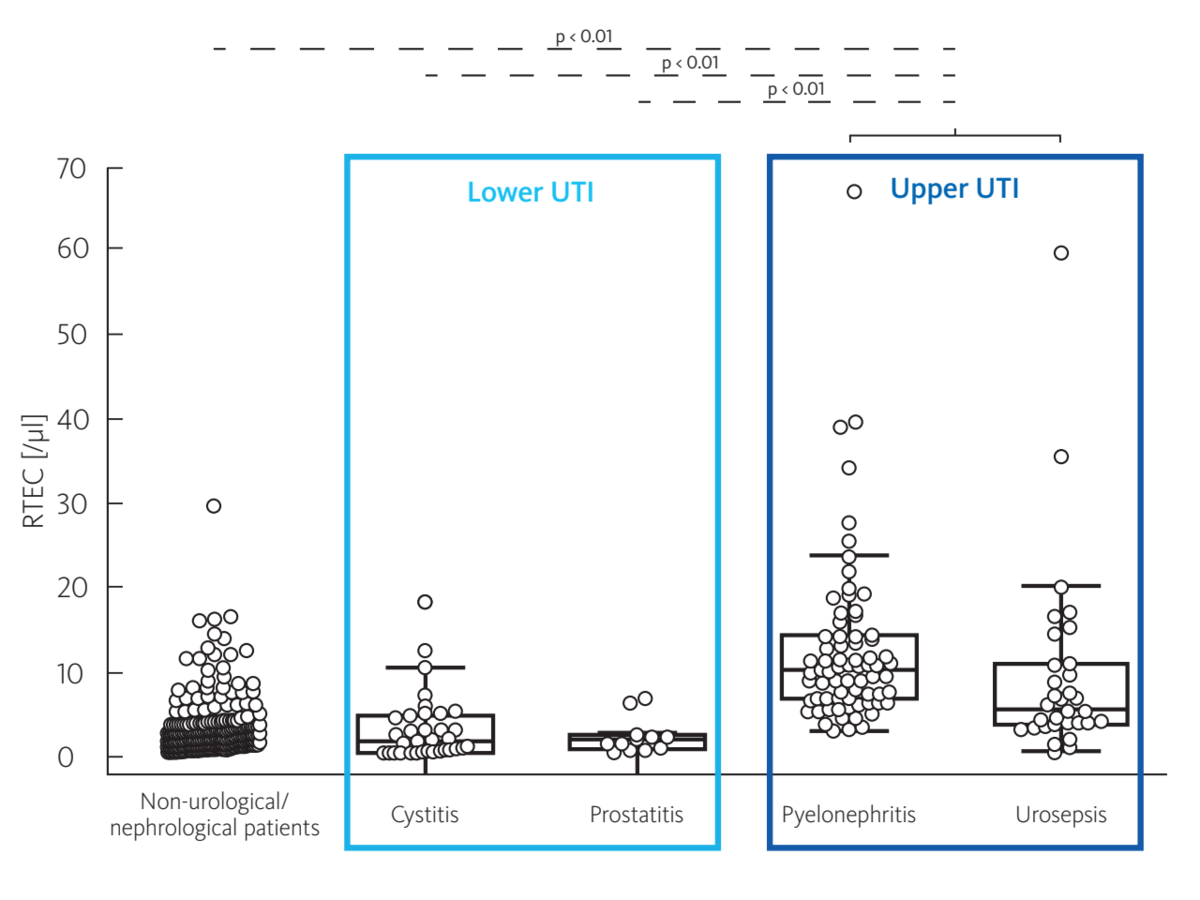
Oyaert et al. konnten auf der UF-Serie das Potenzial für die Differenzierung zwischen einer Infektion der oberen und einer Infektion der unteren Harnwege durch Nutzung des RTEC-Parameters (Nachweis von Epithelzellen aus Nierentubuli) zeigen (Abb. 2). Die Autoren schlussfolgerten, dass bei Patienten mit einer bestätigten HWI das Vorliegen von RTEC auf eine Infektion der oberen Harnwege hindeutet. Bei diesen Untersuchungen war die diagnostische Leistung dieses Parameters besser als die der klassischen Marker für eine Infektion der oberen Harnwege (wie α1-Mikroglobulin) [R33-4].
Literatur
[1] R31-1 Yang X, Chen H, Zheng Y, Qu S, Wang H and Yi F (2022): Disease burden and long-term trends of urinary tract infections: A worldwide report. Front Public Health 10:888205.
[2] R31-2 Flores-Mireles AL, Walker JN, Caparon M and Hultgren SJ (2015): Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nat Rev Microbiol 13(5):269-84.
[3] R31-3 Gupta K and Trautner BW (2013): Diagnosis and management of recurrent urinary tract infections in non-pregnant women. BMJ 346:f3140.
[4] R31-4 Foxman B (2013): Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infect Dis Clin North Am 28(1):1-13.
[5] R31-5 Wilson ML and Gaido L (2004): Laboratory diagnosis of urinary tract infections in adult patients. Clin Infect Dis 38(8):1150-8.
[6] R31-6 Foxman B (2002): Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Am J Med. 2002 Jul 8;113 Suppl 1A:5S-13S.
[7] R31-7 Pujades-Rodriguez M, West RM, Wilcox MH and Sandoe J (2019): Lower Urinary Tract Infections: Management, Outcomes and Risk Factors for Antibiotic Re-prescription in Primary Care. EClinicalMedicine 14:23-31.
[8] R31-8 O'Brien M, Marijam A, Mitrani-Gold FS, Terry L, Taylor-Stokes G and Joshi AV (2023): Unmet needs in uncomplicated urinary tract infection in the United States and Germany: a physician survey. BMC Infect Dis 23(1):281.
[9] R32-1 Keller P (2019): The next step towards faster urinalysis Sysmex Xtra article
[10] R32-2 De Rosa R, Grosso S, Lorenzi S, Bruschetta G, Camporese A (2018): Evaluation of the new Sysmex UF-5000 fluorescence flow cytometry analyser for ruling out bacterial urinary tract infection and for prediction of Gram-negative bacteria in urine cultures. Clinica Chimica Acta 484:171–178.
[11] R32-3 Gilboe HM, Reiakvam OM, Aasen L, Tjade T, Bjerner J, Ranheim TE and Gaustad P (2021): Rapid diagnosis and reduced workload for urinary tract infection using flowcytometry combined with direct antibiotic susceptibility testing. PLoS One 16(7):e0254064
[12] R33-1 Lane DR and Takhar SS (2011): Diagnosis and Management of Urinary Tract Infection and Pyelonephritis. Emerg Med Clin North Am 29(3):539–552.
[13] R33-2 Czaja CA, Scholes D, Hooton TM and Stamm WE (2007): Population-based epidemiologic analysis of acute pyelonephritis. Clin Infect Dis 45(3):273-80.
[14] R33-3 Hudson C and Mortimore G (2020): The diagnosis and management of a patient with acute pyelonephritis. Br J Nurs 29(3):144-150.
[15] R33-4 Oyaert M, Speeckaert M, Boelens J, Delanghe JR (2020): Renal tubular epithelial cells add value in the diagnosis of upper urinary tract pathology. Clin Chem Lab Med 58(4):597–604.